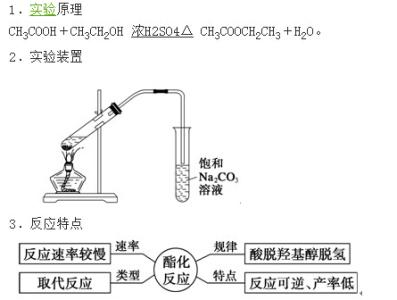
二氧化硅,化学术语,纯的二氧化硅无色,常温下为固体,化学式为SiO?,不溶于水。不溶于酸,但溶于氢氟酸及热浓磷酸,能和熔融碱类起作用。自然界中存在有结晶二氧化硅和无定形二氧化硅两种。二氧化硅用途很广泛,主要用于制玻璃、水玻璃、陶器、搪瓷、耐火材料、气凝胶毡、硅铁、型砂、单质硅、水泥等,在古代,二氧化硅也用来制作瓷器的釉面和胎体。一般的石头主要由二氧化硅、碳酸钙构成。
sio2_二氧化硅 -矿物介绍
二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。天然二氧化硅称为硅石,约占地壳质量的百分之一十二,其存在形式有结晶态和无定形态两种。石英晶体是结晶的二氧化硅,具有不同的晶型和色彩。石英中无色透明的晶体是通常所说的水晶。具有彩色环带状或层状的称为玛瑙(含有杂质)。
二氧化硅矿物是指化学式相同(SiO?),但结构有差异的矿物,这些矿物统称为类质异像体,主要包括石英、方石英和鳞石英。这些矿物在地球上主要存于花岗岩、砂岩和黑硅岩中,而月球上几乎缺乏,主要原因是:化学成分演化上,月球形成一个低硅、高铝的月壳,高硅的花岗质岩石极为稀少;月球在演化上缺乏像地球一样有一个可以结晶出二氧化硅矿物的水系和热水体系。尽管二氧化硅矿物在月球岩石上极为稀少,但对月球岩石的分类和成因的研究具有重要的作用。
月球上的石英矿物最早是在几块类花岗岩碎处中发现的,在霏细岩中同时也充填了不少方石英矿物,从其微细结构和成分的分析表明,这些石英实际上是由方石英变化过来的。后来在粗晶状的月球花岗岩碎块中也发现有石英矿物,根据其同位素的分析结果,这些矿物是41亿年左右,在较深的环境下结晶形成的,说明这些石英不是在岩浆岩形成期间结晶形成的。
月海武岩中的二氧化硅矿物绝大多数是方石英,体积百分数最多可达5%,几乎没有石英矿物,只有在细晶状月海玄武岩中才存在少量的石英矿物,这些方石英具有典型的双晶结构表明:在熔浆冷却过程中,从高温到低温条件下形成的方石英都有。另外,在一些粗晶状的月海玄武岩中也同时存在方石英和鳞石英,但从结构特征看,方石英是由鳞石英转变的,因为鳞石英一般是镶嵌在于不规则的颗粒之间。
sio2_二氧化硅 -理化性质
物理性质
沙的主要成分即二氧化硅
二氧化硅又称硅石,化学式SiO?。自然界中存在有结晶二氧化硅和无定形二氧化硅两种。
结晶二氧化硅因晶体结构不同,分为石英、鳞石英和方石英三种。纯石英为无色晶体,大而透明棱柱状的石英叫水晶。若含有微量杂质的水晶带有不同颜色,有紫水晶、茶晶等。普通的砂是细小的石英晶体,有黄砂(较多的铁杂质)和白砂(杂质少、较纯净)。二氧化硅晶体中,硅原子的4个价电子与4个氧原子形成4个共价键,硅原子位于正四面体的中心,4个氧原子位于正四面体的4个顶角上,SiO?是表示组成的最简式,仅是表示二氧化硅晶体中硅和氧的原子个数之比。二氧化硅是原子晶体。
自然界存在的硅藻土是无定形二氧化硅,是低等水生植物硅藻的遗体,为白色固体或粉末状,多孔、质轻、松软的固体,吸附性强。
不溶于水。
化学性质
化学性质比较稳定。不跟水反应。是酸性氧化物,不跟一般酸反应。气态氟化氢跟二氧化硅反应生成气态四氟化硅。跟热的浓强碱溶液或熔化的碱反应生成硅酸盐和水。跟多种金属氧化物在高温下反应生成硅酸盐。用于制造石英玻璃、光学仪器、化学器皿、普通玻璃、耐火材料、光导纤维,陶瓷等。二氧化硅的性质不活泼,它不与除氟、氟化氢以外的卤素、卤化氢以及硫酸、硝酸、高氯酸作用(热浓磷酸除外)。
常见的浓磷酸(或者说焦磷酸)在高温下即可腐蚀二氧化硅,生成杂多酸
,高温下熔融硼酸盐或者硼酐亦可腐蚀二氧化硅,鉴于此性质,硼酸盐可以用于陶瓷烧制中的助熔剂,除此之外氟化氢也可以可使二氧化硅溶解的酸,生成易溶于水的氟硅酸: 6HF+SiO=HSiF+2HO
二氧化硅一般情况下不与水反应,即与水接触不生成硅酸,但人为规定二氧化硅为硅酸的酸酐。
二氧化硅结构
在大多数微电子工艺感兴趣的温度范围内,二氧化硅的结晶率低到可以被忽略。
尽管熔融石英不是长范围有序,但它却表现出短的有序结构,它的结构可认为是4个氧原子位于四面体的顶点上。多面体中心是一个硅原子。
这样,每4个氧原子近似共价键合到硅原子,满足了硅的化合价外壳。如果每个氧原子是两个多面体的一部分,则氧的化合价也被满足,结果就成了称为石英的规则的晶体结构。
在熔融石英中,某些氧原子,成为氧桥位,与两个硅原子键合。某些氧原子没有氧桥,只和一个硅原子键合。
可以认为热生长二氧化硅主要是由任意方向的多面体网络组成的。与无氧桥位相比,有氧桥的部分越大,氧化层的粘合力就越大,而且受损伤的倾向也越小。干氧氧化层的有氧桥与无氧桥的比率远大于湿氧氧化层。
sio2_二氧化硅 -用途
二氧化硅用于制造平板玻璃,玻璃制品,铸造砂,玻璃纤维,陶瓷彩釉,防锈用喷砂,过滤用砂,熔剂,耐火材料以及制造轻量气泡混凝土。 二氧化硅的用途很广。自然界里比较稀少的水晶可用以制造电子工业的重要 部件、光学仪器和工艺品。 二氧化硅是制造光导纤维的重要原料。 一般较纯净的石英,可用来制造石英玻璃。石英玻璃膨胀系数很小,相当于 普通玻璃的1/18,能经受温度的剧变,耐酸性能好(除HF外),因此,石英玻璃 常用来制造耐高温的化学仪器。 石英砂常用作玻璃原料和建筑材料。
二氧化硅是制造玻璃、石英玻璃、水玻璃、光导纤维、电子工业的重要部件、光学仪器、工艺品和耐火材料的原料,是科学研究的重要材料。
当二氧化硅结晶完美时就是水晶;二氧化硅胶化脱水后就是玛瑙;二氧化硅含水的胶体凝固后就成为蛋白石;二氧化硅晶粒小于几微米时,就组成玉髓、燧石、次生石英岩。物理性质和化学性质均十分稳定的矿产资源,晶体属三方晶系的氧化物矿物,即低温石英(α-石英),是石英族矿物中分布最广的一个矿物种。广义的石英还包括高温石英(β-石英)。石英块又名硅石,主要是生产石英砂(又称硅砂)的原料,也是石英耐火材料和烧制硅铁的原料。
食品工业用作抗结剂、消泡剂、增稠剂、助滤剂、澄清剂。我国《食品添加剂使用卫生标准》(GB2760-2011)规定:可用于蛋粉、糖粉、奶粉、可可粉、可可脂、植物性粉末、速溶咖啡、汤料粉等,最大使用量为15g/kg,粉末香精,最大使用量为80g/kg;固体饮料,最大使用量为0.2g/kg;粮食,1.2g/kg
。
sio2_二氧化硅 -结构
二氧化硅
SiO
晶体有多种晶型,其基本结构单元是四面体,每个Si周围结合4个O,Si在中心,O在四个顶角;许多这样的四面体又通过顶角的O相连接,每个O为两个四面体所共有,即每个O与2个Si相结合。实际上,SiO
晶体是由Si和O按1:2的比例所组成的立体网状结构的晶体。因此,通常用SiO
来表示二氧化硅的组成。
sio2_二氧化硅 -物理性质
具有硬度大、耐高温、耐震、电绝缘的性能。可以透过可见光,以及红、紫外线。
sio2_二氧化硅 -化学性质
二氧化硅
二氧化硅是酸性氧化物,对应的最高价水化物为硅酸(H
SiO
)。二氧化硅化学性质不活泼,不容易与水和大部分酸发生反应。通常只能与碱性氧化物反应生成盐。氢氟酸(HF)是唯一可以与之反应的酸。
二氧化硅是酸性氧化物、硅酸的酸酐。化学性质很稳定。不溶于水也不跟水反应,不跟一般的酸起作用。能与氟化氢气体或氢氟酸反应生成四氟化硅气体。
有酸性氧化物的其它通性,高温下能与碱(强碱溶液或熔化的碱)反应生成盐和水。常温下强碱溶液与SiO
缓慢地作用生成相应的硅酸盐。强碱溶液能腐蚀玻璃,故贮存强碱溶液的玻璃瓶不能用磨口玻璃塞,若采用玻璃塞(玻璃中含SiO
),会生成有粘性的硅酸钠,将玻璃瓶塞和瓶口粘结在一起。玻璃瓶内不能久放浓碱液。
高温下二氧化硅与碱性氧化物或某些金属的碳酸盐共熔,生成硅酸盐。
将此高温下熔融状态的硅酸钠降温、冷却,可得石英玻璃,它有良好的透过紫外线性能,可作水银灯罩、耐高温的化学仪器、石英坩埚和光学仪器等。
sio2_二氧化硅 -生产工艺
a.利用稻壳灰,锅炉灰在温度为140--170℃,反应压力为5--7MPa,反应时间为4-5小时的条件下,与纯碱溶液在搅拌反应釜内进行化学反应;
b.将液体用箱式压滤机进行第一次过滤,滤液经冷却器快速降温至20-22℃,滤液在冷却过程中有大量的二氧化硅胶状沉淀析出,和碳酸钠分解出来;
c.将分解出的碳酸钠和析出的二氧化硅进行第二次过滤,然后再将箱式压滤机内的二氧化硅过滤,清水洗涤至中性;
d.将箱式压滤机内的二氧化硅取出,经磨浆打浆,酸中和后,沉淀8小时,第三次用箱式压滤机过滤,除去盐水,在300℃以上的热风气流烘干系统内烘干,即可得到325目以上,325目以下两个品种的高级超细活性二氧化硅;
e.将上述D或得的二种品种的高级超细活性二氧化硅,在800--1000℃高温烘炉烘干即可得到代替气相法生产的二氧化硅产品。
sio2_二氧化硅 -应用领域
玻璃
二氧化硅
平板玻璃、浮法玻璃、玻璃制品(玻璃罐、玻璃瓶、玻璃管等)、光学玻璃、玻璃纤维、玻璃仪器、导电玻璃、玻璃布及防射线特种玻璃等的主要原料
瓷器的胚料和釉料,窑炉用高硅砖、普通硅砖以及碳化硅等的原料
硅金属、硅铁合金和硅铝合金等的原料或添加剂、熔剂
混凝土、胶凝材料、筑路材料、人造大理石、水泥物理性能检验材料(即水泥标准砂)等
硅化合物和水玻璃等的原料,硫酸塔的填充物,无定形二氧化硅微粉
铸造型砂的主要原料,研磨材料(喷砂、硬研磨纸、砂纸、砂布等)
高纯度金属硅、通讯用光纤等
填料(可提高耐磨性)
填料(可提高涂料的耐候性)
医学新加坡国立大学工程学院生物工程系的研究人员研制出一种新技术,能够通过二氧化硅纳米粒子将红外光转化为紫外光和可见光,为深层肿瘤的非侵入性疗法铺平了道路。据称,该技术能够抑制肿瘤生长,控制其基因表达,是世界上首个使用纳米粒子治疗深层肿瘤的非侵入性光动力疗法。
sio2_二氧化硅 -危害介绍
二氧化硅
二氧化硅在日常生活、生产和科研等方面有着重要的用途,但有时也会对人体造成危害。
二氧化硅的粉尘极细,比表面积达到100m /g以上,可以悬浮在空气中,如果人长期吸入含有二氧化硅的粉尘,就会患硅肺病(因硅旧称为矽,硅肺旧称为矽肺)。
硅肺是一种职业病,它的发生及严重程度,取决于空气中粉尘的含量和粉尘中二氧化硅的含量,以及与人的接触时间等。长期在二氧化硅粉尘含量较高的地方,如采矿、翻砂、喷砂、制陶瓷、制耐火材料等场所工作的人易患此病。
因此,在这些粉尘较多的工作场所,因采取严格的劳动保护措施,采用多种技术和设备控制工作场所的粉尘含量,以保证工作人员的身体健康。
 爱华网
爱华网