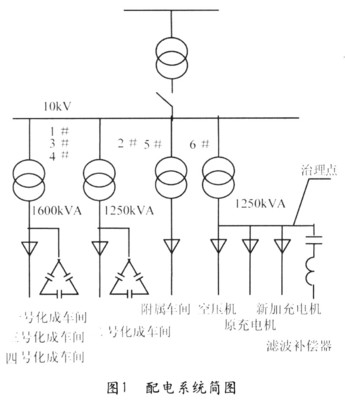
酸是指电离时生成的阳离子全部是氢离子(H+)的化合物,与碱相对。酸碱离子理论是阿累尼乌其斯(Arrhenius)根据他的电离学说提出来的,他认为在水中能电离出氢离子并且不产生其它阳离子的物质叫酸。盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、磷酸(H3PO4)碳酸(H2CO3)在水溶液中电离时,产生的阴离子(酸根)虽然各不相同,但产生的阳离子(H+)却是相同的,因此它们在性质上有共同的地方,例如具有酸味;能溶解许多金属;能使紫色石蕊试纸变红等等,这些性质实际上就是H+的性质。
酸_酸 -化学定义
阿伦尼乌斯酸
阿伦尼乌斯(S.Arrhenius)酸指的是溶解于水时释放出的阳离子全部是氢离子(H+)的化合物。这类物质大部分易溶于水中,少部分,如:硅酸,难溶于水.酸的水溶液一般可导电,其导电性质与其在水中电离度有关,部分酸在水中以分子的形式存在,不导电;部分酸在水中离解为正负离子,可导电。
酸
布朗斯特-劳里酸
布朗斯特-劳里(Br?nsted-Lowry)认为能提供质子的粒子是酸,能接受质子的粒子是碱。它比阿伦尼乌斯的定义要广泛,因为这种定义下的酸包含了不溶于水的物质。
路易斯酸
路易斯(Lewis)酸被定义为电子的接受者,这是范围最广泛的定义,酸可以和碱进行中和作用(neutralization),生成水和盐,因为路易斯酸碱不需要氢或氧的存在。酸_酸 -酸的命名
根据酸在水溶液中电离度的大小,分为强酸和弱酸;根据酸中可电离氢离子的数目,分为一元酸(如HCl、CH3COOH)、二元酸(如H2C2O4、H2SO4)和三元酸(如H3PO4)等;根据酸中含氧与否,分为含氧酸和无氧酸。
无氧酸称氢某酸,其中除氢氯酸HCl(盐酸)、氢溴酸HBr和氢碘酸HI外都是弱酸,如氢氟酸HF和氢硫酸H2S等。含氧酸的命名:对于分子中只含一个成酸元素的简单含氧酸,将其较为常见的一种称某酸,其他含氧酸按成酸元素的氧化数较某酸高、低或有无过氧-O-O-结构而命名。例如氯酸HClO3(氯的氧化数为+5)、高氯酸HClO4(氧化数+7)、亚氯酸HClO2(氧化数为+3)、次氯酸HClO(氧化数+1);又如H2SO5、 H2S2O8中含有-O-O-键,称过氧一硫酸、过氧二硫酸。两个简单含氧酸缩去一分子水后生成的酸称焦酸(或称一缩某酸),例如:
也有用重作词头来命名的,例如:简单含氧酸脱去(全部)氢氧基而生成的基称酰基,如-SO2-称硫酰基,CrO2Cl2称铬酰氯。若把含氧酸的化学式写成MOm(OH)n(M为金属),就可以根据m值来判断常见含氧酸的强弱:
m=0极弱酸,如硼酸H3BO3
m=1弱酸,如亚硫酸H2SO3、磷酸H3PO4
m=2强酸,如硫酸H2SO4、硝酸HNO3
m=3极强酸,如高氯酸HClO4
酸_酸 -主要分类
根据酸在水溶液中电离度的大小,有强酸和弱酸之分。

一般认为,强酸在水溶液中完全电离,如盐酸、硝酸;弱酸在水溶液中部分电离,如乙酸、碳酸。
酸
强酸:高氯酸,氢碘酸,硫酸,氢溴酸,盐酸,硝酸,碘酸等。
中强酸:草酸(乙二酸),亚硫酸,磷酸,丙酮酸,碳酸(有人认为是弱酸),亚硝酸
弱酸:柠檬酸,氢氟酸,苹果酸,葡萄糖酸,甲酸,乳酸,苯甲酸,丙烯酸,乙酸,丙酸,硬脂酸,氢硫酸,次氯酸,硼酸
含氧酸
 爱华网
爱华网