线粒体(mitochondrion)是细胞中制造能量的结构,科学界也给线粒体起了一个别名叫做“power house”,即细胞的发电厂。一个细胞内含有线粒体的数目可以从几百个到数千个不等,越活跃的细胞含有的线粒体数目越多,如时刻跳动的心脏细胞和经常思考问题的大脑细胞含有线粒体的数目最大,皮肤细胞含有线粒体的数目比较少。线粒体或粒体线(mitochondrion),是一种存在于大多数真核细胞中的由两层膜包被的细胞器,直径在0.5到10微米左右。除了溶组织内阿米巴、篮氏贾第鞭毛虫以及几种微孢子虫外,大多数真核细胞或多或少都拥有线粒体,但它们各自拥有的线粒体在大小、数量及外观等方面上都有所不同。这种细胞器拥有自身的遗传物质和遗传体系,但因其基因组大小有限,所以线粒体是一种半自主细胞器。线粒体是细胞内氧化磷酸化和合成三磷酸腺苷(ATP)的主要场所,为细胞的活动提供了能量,所以有“细胞动力工厂”之称。除了为细胞供能外,线粒体还参与诸如细胞分化、细胞信息传递和细胞凋亡等过程,并拥有调控细胞生长和细胞周期的能力。
线粒体_线粒体 -概述
细胞结构
线粒体(mitochondrion)是细胞中制造能量的结构,科学界也给线粒体起了一个别名叫做“power house”,即细胞的发电厂。一个细胞内含有线粒体的数目可以从十几个到数百个不等,越活跃的细胞含有的线粒体数目越多,如时刻跳动的心脏细胞和经常思考问题的大脑细胞含有线粒体的数目最大,皮肤细胞含有线粒体的数目比较少。
科学家发现农民皮肤细胞的线粒体因常年在室外劳动受到损伤的程度远远高于其他室内职业者,线粒体受到损伤,细胞就会缺乏能量而死亡。我们的面部常年暴露在外,时时刻刻都在经受风吹雨打和各种污染颗粒的侵袭,因此面部细胞经常是因为过度的磨难而早夭。
线粒体是1850年发现的,1898年命名。线粒体由两层膜包被,外膜平滑,内膜向内折叠形成嵴,两层膜之间有腔,线粒体中央是基质。基质内含有与三羧酸循环所需的全部酶类,内膜上具有呼吸链酶系及ATP酶复合体。线粒体是细胞内氧化磷酸化和形成ATP的主要场所,有细胞"动力工厂"(powerplant)之称。另外,线粒体有自身的DNA和遗传体系,但线粒体基因组的基因数量有限,因此,线粒体只是一种半自主性的细胞器。
在多数细胞中,线粒体均匀分布在整个细胞质中,但在某些些细胞中,线粒体的分布是不均一的,有时线粒体聚集在细胞质的边缘。在细胞质中,线粒体常常集中在代谢活跃的区域,因为这些区域需要较多的ATP,如肌细胞的肌纤维中有很多线粒体。另外,在精细胞、鞭毛、纤毛和肾小管细胞的基部都是线粒体分布较多的地方。线粒体除了较多分布在需要ATP的区域外,也较为集中的分布在有较多氧化反应底物的区域,如脂肪滴,因为脂肪滴中有许多要被氧化的脂肪。
线粒体_线粒体 -形态与分布
线粒体结构
线粒体一般呈粒状或杆状,但因生物种类和生理状态而异,可呈环形,哑铃形、线状、分杈状或其它形状。主要化学成分是蛋白质和脂类,其中蛋白质占线粒体干重的65%-70%,脂类占25%-30%。一般直径0.5~1μm,长1.5~3.0μm,在胰脏外分泌细胞中可长达10~20μm,称巨线粒体。数目一般数百到数千个,植物因有叶绿体的缘故,线粒体数目相对较少;肝细胞约1300个线粒体,占细胞体积的20%;单细胞鞭毛藻仅1个,酵母细胞具有一个大型分支的线粒体,巨大变形中达50万个;许多哺乳动物成熟的红细胞中无线粒体。通常结合在维管上,分布在细胞功能旺盛的区域。如在肝细胞中呈均匀分布,在肾细胞中靠近微血管,呈平行或栅状排列,肠表皮细胞中呈两极性分布,集中在顶端和基部,在精子中分布在鞭毛中区。线粒体在细胞质中可以向功能旺盛的区域迁移,微管是其导轨,由马达蛋白提供动力。
线粒体_线粒体 -超微结构
线粒体
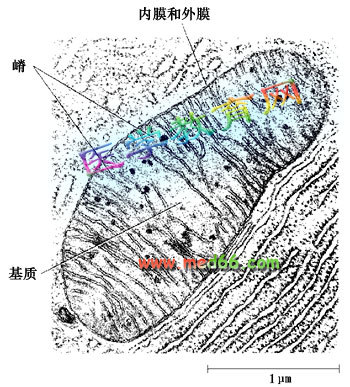
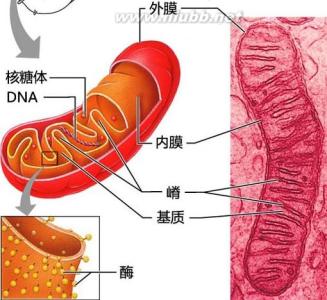
线粒体由内外两层膜封闭,包括外膜、内膜、膜间隙和基质四个功能区隔。在肝细胞线粒体中各功能区隔蛋白质的含量依次为:基质67%,内膜21%,外8%膜,膜间隙4%。
外膜
(out membrane)含40%的脂类和60%的蛋白质,具有孔蛋白(porin)构成的亲水通道,允许分子量为5kDa以下的分子通过,1kDa以下的分子可自由通过。标志酶为单胺氧化酶。
内膜
(inner membrane)含100种以上的多肽,蛋白质和脂类的比例高于3:1。心磷脂含量高(达20%)、缺乏胆固醇,类似于细菌。通透性很低,仅允许不带电荷的小分子物质通过,大分子和离子通过内膜时需要特殊的转运系统。如:丙酮酸和焦磷酸是利用H梯度协同运输。线粒体氧化磷酸化的电子传递链位于内膜,因此从能量转换角度来说,内膜起主要的作用。内膜的标志酶为细胞色素c氧化酶。
膜间隙
(intermembrane space)是内外膜之间的腔隙,延伸至嵴的轴心部,腔隙宽约6-8nm。由于外膜具有大量亲水孔道与细胞质相通,因此膜间隙的pH值与细胞质的相似。标志酶为腺苷酸激酶。
基质
(matrix)为内膜和嵴包围的空间。除糖酵解在细胞质中进行外,其他的生物氧化过程都在线粒体中进行。催化三羧酸循环,脂肪酸和丙酮酸氧化的酶类均位于基质中,其标志酶为苹果酸脱氢酶。基质具有一套完整的转录和翻译体系。包括线粒体DNA(mtDNA),70S型核糖体,tRNA 、rRNA、DNA聚合酶、氨基酸活化酶等。基质中还含有纤维丝和电子密度很大的致密颗粒状物质,内含Ca、Mg、Zn等离子
线粒体_线粒体 -历史
发现者
线粒体的研究是从19世纪50年代末开始的。
1857年,瑞士解剖学家及生理学家阿尔伯特・冯・科立克在肌肉细胞中发现了颗粒状结构。另外的一些科学家在其他细胞中也发现了同样的结构,证实了科立克的发现。德国病理学家及组织学家理查德・阿尔特曼将这些颗粒命名为“原生粒”(bioblast)并于1886年发明了一种鉴别这些颗粒的染色法。阿尔特曼猜测这些颗粒可能是共生于细胞内的独立生活的细菌。
1898年,德国科学家卡尔・本达因这些结构时而呈线状时而呈颗粒状,所以用希腊语中“线”和“颗粒”对应的两个词――“mitos”和“chondros”――组成“mitochondrion”来为这种结构命名,这个名称被沿用至今。一年后,美国化学家莱昂诺尔・米歇利斯开发出用具有还原性的健那绿染液为线粒体染色的方法,并推断线粒体参与某些氧化反应。这一方法于1900年公布,并由美国细胞学家埃德蒙・文森特・考德里推广。德国生物化学家奥托・海因里希・沃伯格成功完成线粒体的粗提取且分离得到一些催化与氧有关的反应的呼吸酶,并提出这些酶能被氰化物(如氢氰酸)抑制的猜想。
英国生物学家大卫・基林在1923年至1933年这十年间对线粒体内的氧化还原链(redoxchain)的物质基础进行探索,辨别出反应中的电子载体――细胞色素。
沃伯格于1931年因“发现呼吸酶的性质及作用方式”被授予诺贝尔生理学或医学奖。
线粒体_线粒体 -半自主性及内共生学说
1963年M. 和 S.nass发现线粒体DNA(mtDNA)后,人们又在线粒体中发现了RNA、DNA聚合酶、RNA聚合酶、tRNA、核糖体、氨基酸活化酶等进行DNA复制、转录和蛋白质翻译的全套装备,说明线粒体具有独立的遗传体系。
虽然线粒体也能合成蛋白质,但是合成能力有限。线粒体1000多种蛋白质中,自身合成的仅十余种。线粒体的核糖体蛋白、氨酰tRNA合成酶、许多结构蛋白,都是核基因编码, 在细胞质中合成后,定向转运到线粒体的,因此称线粒体为半自主细胞器。
利用标记氨基酸培养细胞,用氯霉素和放线菌酮分别抑制线粒体和细胞质蛋白质合成的方法,发现人的线粒体DNA编码的多肽为细胞色素c氧化酶的3个亚基,F0的2个亚基,NADH脱氢酶的7个亚基和细胞色素b等13条多肽。此外线粒体DNA还能合成12S和16S rRNA及22种tRNA。
mtDNA分子为环状双链DNA分子,外环为重链(H),内环为轻链(L )。基因排列非常紧凑,除与mtDNA复制及转录有关的一小段区域外,无内含子序列。每个线粒体含数个m tDNA,动物mtDNA 约16-20kb,大多数基因由H链转录,包括2个rRNA,14个tRNA 和12个编码多肽的mRNA , L链编码另外8个tRNA和一条多肽链。mtDNA上的基因相互连接或仅间隔几个核苷酸序列, 一些多肽基因相互重叠, 几乎所有阅读框都缺少非翻译区域。很多基因没有完整的终止密码, 而仅以T或TA结尾,mRNA的终止信号是在转录后加工时加上去的。
线粒体在形态,染色反应、化学组成、物理性质、活动状态、遗传体系等方面,都很像细菌,所以人们推测线粒体起源于内共生。按照这种观点,需氧细菌被原始真核细胞吞噬以后,有可能在长期互利共生中演化形成了现在的线粒体。在进化过程中好氧细菌逐步丧失了独立性,并将大量遗传信息转移到了宿主细胞中,形成了线粒体的半自主性。
线粒体遗传体系确实具有许多和细菌相似的特征,如:
① DNA为环形分子,无内含子;
②核糖体为70S型;
③ RNA聚合酶被溴化乙锭抑制不被放线菌素D所抑制;
④ tRNA、氨酰基-tRNA合成酶不同于细胞质中的;
⑤ 蛋白质合成的起始氨酰基tRNA是N-甲酰甲硫氨酰tRNA,对细菌蛋白质合成抑制剂氯霉素敏感对细胞质蛋白合成抑制剂放线菌酮不敏感。
此外哺乳动物mtDNA的遗传密码与通用遗传密码有以下区别:
① UGA不是终止信号,而是色氨酸的密码;
② 多肽内部的甲硫氨酸由AUG和AUA两个密码子编码,起始甲硫氨酸由AUG,AUA,AUU和AUC四个密码子编码;
③ AGA,AGG不是精氨酸的密码子,而是终止密码子,线粒体密码系统中有4个终止密码子(UAA,UAG,AGA,AGG)。
mtDNA表现为母系遗传。其突变率高于核DNA,并且缺乏修复能力。有些遗传病,如Leber遗传性视神经病,肌阵挛性癫痫等均与线粒体基因突变有关。
线粒体_线粒体 -增殖
线粒体的增殖是通过已有的线粒体的分裂,有以下几种形式:
1、间壁分离,分裂时先由内膜向中心皱褶,将线粒体分类两个,常见于鼠肝和植物产生组织中
2、收缩后分离,分裂时通过线粒体中部缢缩并向两端不断拉长然后分裂为两个,见于蕨类和酵母线粒体中。
3、出芽,见于酵母和藓类植物,线粒体出现小芽,脱落后长大,发育为线粒体。
线粒体_线粒体 -特性
线粒体
线粒体是对各种损伤最为敏感的细胞器之一。在细胞损伤时最常见的病理改变可概括为线粒体数量、大小和结构的改变:
1、数量的改变 线粒体的平均寿命约为10天。衰亡的线粒体可通过保留的线粒体直接分裂为二予以补充。在病理状态下,线粒体的增生实际上是对慢性非特异性细胞损伤的适应性反应或细胞功能升高的表现。例如心瓣膜病时的心肌线粒体、周围血液循环障碍伴间歇性跛行时的骨骼肌线粒体的呈增生现象。
线粒体数量减少则见于急性细胞损伤时线粒体崩解或自溶的情况下,持续约15分钟。慢性损伤时由于线粒体逐渐增生,故一般不见线粒体减少(甚至反而增多)。此外,线粒体的减少也是细胞未成熟和(或)去分化的表现。
2、大小改变细胞损伤时最常见的改变为线粒体肿大。根据线粒体的受累部位可分为基质型肿胀和嵴型肿胀二种类型,而以前者为常见。基质型肿胀时线粒体变大变圆,基质变浅、嵴变短变少甚至消失。在极度肿胀时,线粒体可转化为小空泡状结构。此型肿胀为细胞水肿的部分改变。光学显微镜下所谓的浊肿细胞中所见的细颗粒即肿大的线粒体。嵴型肿较少见,此时的肿胀局限于嵴内隙,使扁平的嵴变成烧瓶状乃至空泡状,而基质则更显得致密。嵴型肿胀一般为可复性,但当膜的损伤加重时,可经过混合型而过渡为基质型。
线粒体为对损伤极为敏感的细胞器,其肿胀可由多种损伤因子引起,其中最常见的为缺氧;此外,微生物毒素、各种毒物、射线以及渗透压改变等亦可引起。但轻度肿大有时可能为其功能升高的表现,较明显的肿胀则恒为细胞受损的表现。但只要损伤不过重、损伤因子的作用不过长,肿胀仍可恢复。
线粒体的增大有时是器官功能负荷增加引起的适应性肥大,此时线粒体的数量也常增多,例如见于器官肥大时。反之,器官萎缩时,线粒体则缩小、变少。
3、结构的改变线粒体嵴是能量代谢的明显指征,但嵴的增多未必均伴有呼吸链酶的增加。嵴的膜和酶平行增多反映细胞的功能负荷加重,为一种适应状态的表现;反之,如嵴的膜和酶的增多不相平行,则是胞浆适应功能障碍的表现,此时细胞功能并不升高。
在急性细胞损伤时(大多为中毒或缺氧),线粒体的嵴被破坏;慢性亚致死性细胞损伤或营养缺乏时,线粒体的蛋白合成受障,以致线粒体几乎不再能形成新的嵴。
根据细胞损伤的种类和性质,可在线粒体基质或嵴内形成病理性包含物。这些包含物有的呈晶形或副晶形(可能由蛋白构成),如在线粒体性肌病或进行性肌营养不良时所见,有的呈无定形的电子致密物,常见于细胞趋于坏死时,乃线粒体成分崩解的产物(脂质和蛋白质),被视为线粒体不可复性损伤的表现。线粒体损伤的另一种常见改变为髓鞘样层状结构的形成,这是线粒体膜损伤的结果。
衰亡或受损的线粒体,最终由细胞的自噬过程加以处理并最后被溶酶体酶所降解消化 。
线粒体_线粒体 -功能
能量转化
线粒体是真核生物进行氧化代谢的部位,是糖类、脂肪和氨基酸最终氧化释放能量的场所。线粒体负责的最终氧化的共同途径是三羧酸循环与氧化磷酸化,分别对应有氧呼吸的第二、三阶段。细胞质基质中完成的糖酵解和在线粒体基质中完成的三羧酸循环在会产还原型烟酰胺腺嘌呤二核苷酸(reducednicotinarnideadeninedinucleotide,NADH)和还原型黄素腺嘌呤二核苷酸(reducedflavinadenosinedinucleotide,FADH2)等高能分子,而氧化磷酸化这一步骤的作用则是利用这些物质还原氧气释放能量合成ATP。在有氧呼吸过程中,1分子葡萄糖经过糖酵解、三羧酸循环和氧化磷酸化将能量释放后,可产生30-32分子ATP(考虑到将NADH运入线粒体可能需消耗2分子ATP)。如果细胞所在环境缺氧,则会转而进行无氧呼吸。此时,糖酵解产生的丙酮酸便不再进入线粒体内的三羧酸循环,而是继续在细胞质基质中反应(被NADH还原成乙醇或乳酸等发酵产物),但不产生ATP。所以在无氧呼吸过程中,1分子葡萄糖只能在第一阶段产生2分子ATP。
三羧酸循环
糖酵解中生成的每分子丙酮酸会被主动运输转运穿过线粒体膜。进入线粒体基质后,丙酮酸会被氧化,并与辅酶A结合生成CO2、还原型辅酶Ⅰ和乙酰辅酶A。乙酰辅酶A是三羧酸循环(也称为“柠檬酸循环”或“Krebs循环”)的初级底物。参与该循环的酶除位于线粒体内膜的琥珀酸脱氢酶外都游离于线粒体基质中。在三羧酸循环中,每分子乙酰辅酶A被氧化的同时会产生起始电子传递链的还原型辅因子(包括3分子NADH和1分子FADH2)以及1分子三磷酸鸟苷(GTP)。
氧化磷酸化
NADH和FADH2等具有还原性的分子(在细胞质基质中的还原当量可从由逆向转运蛋白构成的苹果酸-天冬氨酸穿梭系统或通过磷酸甘油穿梭作用进入电子传递链)在电子传递链里面经过几步反应最终将氧气还原并释放能量,其中一部分能量用于生成ATP,其余则作为热能散失。在线粒体内膜上的酶复合物(NADH-泛醌还原酶、泛醌-细胞色素c还原酶、细胞色素c氧化酶)利用过程中释放的能量将质子逆浓度梯度泵入线粒体膜间隙。虽然这一过程是高效的,但仍有少量电子会过早地还原氧气,形成超氧化物等活性氧(ROS),这些物质能引起氧化应激反应使线粒体性能发生衰退。
当质子被泵入线粒体膜间隙后,线粒体内膜两侧便建立起了电化学梯度,质子就会有顺浓度梯度扩散的趋势。质子唯一的扩散通道是ATP合酶(呼吸链复合物V)。当质子通过复合物从膜间隙回到线粒体基质时,电势能被ATP合酶用于将ADP和磷酸合成ATP。这个过程被称为“化学渗透”,是一种协助扩散。彼得・米切尔就因为提出了这一假说而获得了1978年诺贝尔奖。1997年诺贝尔奖获得者保罗・博耶和约翰・瓦克阐明了ATP合酶的机制。
储存钙离子
线粒体可以储存钙离子,可以和内质网、细胞外基质等结构协同作用,从而控制细胞中的钙离子浓度的动态平衡。线粒体迅速吸收钙离子的能力使其成为细胞中钙离子的缓冲区。在线粒体内膜膜电位的驱动下,钙离子可由存在于线粒体内膜中的单向运送体输送进入线粒体基质;排出线粒体基质时则需要钠-钙交换蛋白的辅助或通过钙诱导钙释放(calcium-induced-calcium-release,CICR)机制。在钙离子释放时会引起伴随着较大膜电位变化的“钙波”(calciumwave),能激活某些第二信使系统蛋白,协调诸如突触中神经递质的释放及内分泌细胞中激素的分泌。线粒体也参与细胞凋亡时的钙离子信号转导。
其他功能
除了合成ATP为细胞提供能量等主要功能外,线粒体还承担了许多其他生理功能。
・调节膜电位并控制细胞程序性死亡:当线粒体内膜与外膜接触位点处生成了由己糖激酶(细胞质基质蛋白)、外周苯并二氮受体和电压依赖阴离子通道(线粒体外膜蛋白)、肌酸激酶(线粒体膜间隙蛋白)、ADP-ATP载体(线粒体内膜蛋白)和亲环蛋白D(线粒体基质蛋白)等多种蛋白质组成的通透性转变孔道(PT孔道)后,会使线粒体内膜通透性提高,引起线粒体跨膜电位的耗散,从而导致细胞凋亡。线粒体膜通透性增加也能使诱导凋亡因子(AIF)等分子释放进入细胞质基质,破坏细胞结构。
・细胞增殖与细胞代谢的调控;
・合成胆固醇及某些血红素。
线粒体的某些功能只有在特定的组织细胞中才能展现。例如,只有肝脏细胞中的线粒体才具有对氨气(蛋白质代谢过程中产生的废物)造成的毒害解毒的功能
线粒体_线粒体 -病理
线粒体是对各种损伤最为敏感的细胞器之一。在细胞损伤时最常见的病理改变可概括为线粒体数量、大小和结构的改变:
数量的改变
线粒体的平均寿命约为10天。衰亡的线粒体可通过保留的线粒体直接分裂为二予以补充。在病理状态下,线粒体的增生实际上是对慢性非特异性细胞损伤的适应性反应或细胞功能升高的表现。例如心瓣膜病时的心肌线粒体、周围血液循环障碍伴间歇性跛行时的骨骼肌线粒体的呈增生现象。
线粒体数量减少则见于急性细胞损伤时线粒体崩解或自溶的情况下,持续约15分钟。慢性损伤时由于线粒体逐渐增生,故一般不见线粒体减少(甚至反而增多)。此外,线粒体的减少也是细胞未成熟和(或)去分化的表现。
大小改变
细胞损伤时最常见的改变为线粒体肿大。根据线粒体的受累部位可分为基质型肿胀和嵴型肿胀二种类型,而以前者为常见。基质型肿胀时线粒体变大变圆,基质变浅、嵴变短变少甚至消失(图1-9)。在极度肿胀时,线粒体可转化为小空泡状结构。此型肿胀为细胞水肿的部分改变。光学显微镜下所谓的浊肿细胞中所见的细颗粒即肿大的线粒体。嵴型肿较少见,此时的肿胀局限于嵴内隙,使扁平的嵴变成烧瓶状乃至空泡状,而基质则更显得致密。嵴型肿胀一般为可复性,但当膜的损伤加重时,可经过混合型而过渡为基质型。
线粒体为对损伤极为敏感的细胞器,其肿胀可由多种损伤因子引起,其中最常见的为缺氧;此外,微生物毒素、各种毒物、射线以及渗透压改变等亦可引起。但轻度肿大有时可能为其功能升高的表现,较明显的肿胀则恒为细胞受损的表现。但只要损伤不过重、损伤因子的作用不过长,肿胀仍可恢复。
线粒体的增大有时是器官功能负荷增加引起的适应性肥大,此时线粒体的数量也常增多,例如见于器官肥大时。反之,器官萎缩时,线粒体则缩小、变少。
结构的改变
线粒体嵴是能量代谢的明显指征,但嵴的增多未必均伴有呼吸链酶的增加。嵴的膜和酶平行增多反映细胞的功能负荷加重,为一种适应状态的表现;反之,如嵴的膜和酶的增多不相平行,则是胞浆适应功能障碍的表现,此时细胞功能并不升高。
在急性细胞损伤时(大多为中毒或缺氧),线粒体的嵴被破坏;慢性亚致死性细胞损伤或营养缺乏时,线粒体的蛋白合成受障,以致线粒体几乎不再能形成新的嵴。
根据细胞损伤的种类和性质,可在线粒体基质或嵴内形成病理性包含物。这些包含物有的呈晶形或副晶形(可能由蛋白构成),如在线粒体性肌病或进行性肌营养不良时所见,有的呈无定形的电子致密物,常见于细胞趋于坏死时,乃线粒体成分崩解的产物(脂质和蛋白质),被视为线粒体不可复性损伤的表现。线粒体损伤的另一种常见改变为髓鞘样层状结构的形成,这是线粒体膜损伤的结果。
衰亡或受损的线粒体,最终由细胞的自噬过程加以处理并最后被溶酶体酶所降解消化。
线粒体_线粒体 -线粒体与衰老
线粒体是直接利用氧气制造能量的部位,90%以上吸入体内的氧气被线粒体消耗掉。但是,氧是个“双刃剑”,一方面生物体利用氧分子制造能量,另一方面氧分子在被利用的过程中会产生极活泼的中间体(活性氧自由基)伤害生物体造成氧毒性。生物体就是在不断地与氧毒性进行斗争中求得生存和发展的,氧毒性的存在是生物体衰老的最原初的原因。线粒体利用氧分子的同时也不断受到氧毒性的伤害,线粒体损伤超过一定限度,细胞就会衰老死亡。生物体总是不断有新的细胞取代衰老的细胞以维持生命的延续,这就是细胞的新陈代谢。
线粒体_线粒体 -线粒体与美容
保持线粒体完好无损就是保持了细胞的活力,拥有健康的肌肤细胞就是留住了青春。这个道理只有细细的品味,才能从中受益。皮肤细胞的新陈代谢就是自然的皮肤更新过程,新陈代谢旺盛细胞更新速率就快,总有一些新生的细胞出现在脸上,才有美丽青春的魅力。
线粒体_线粒体 -线粒体与疾病
人类线粒体出现问题会导致线粒体病,线粒体病是一大类遗传代谢病,线粒体病主要包括:母系遗传Leigh综合征,线粒体肌病,多系统疾病、心肌病、进行性眼外肌麻痹,Leer遗传性视神经病,线粒体肌病,肌病,糖尿病和耳聋、共济失调舞蹈病、细胞外基质慢性游走性红斑、进行性眼外肌麻痹、肌红蛋白尿电机神经元疾病,铁粒幼细胞贫血、MERRF-线粒体肌病、肌阵挛(癫痫)、线粒体脑肌病、、MERRF、线粒体肌病、共济失调并发色素性视网膜炎、,家族性双侧纹状体坏死、共济失调并发色素性视网膜炎、家族性双侧纹状体坏死、骨骼肌溶解症、婴儿猝死综合征等等疾病。
线粒体病遗传方式复杂,导致疾病的原因主要由核基因和线粒体基因造成,临床表现复杂,确切病因的诊断十分困难,往往通过大分子酶学活性检测分析并结合遗传学基因分析的双重手段确定病因。
线粒体基因组属于母系遗传,为了避免新生儿缺陷,产前妈妈的线粒体基因组分析十分必要。
线粒体_线粒体 -相关名词
蛋白质寻靶
(protein targeting)
游离核糖体合成的蛋白质在细胞内的定位是由前体蛋白本身具有的引导信号决定的。不同类型的引导信号可以引导蛋白质定位到特定的细胞器,如线粒体、叶绿体、细胞核和过氧化物酶体等。这些蛋白质在游离核糖体上合成释放之后需要自己寻找目的地,因此称为蛋白质寻靶。
翻译后转运
(post-translationaltranslocation)
游离核糖体上合成的蛋白质必须等蛋白质完全合成并释放到胞质溶胶后才能被转运,所以将这种转运方式称为翻译后转运。通过这种方式转运的蛋白质包括线粒体、叶绿体和细胞核的部分蛋白,以及过氧化物酶体的全部蛋白等。在游离核糖体上合成的蛋白质中有相当一部分直接存在于胞质溶胶中,包括细胞骨架蛋白、各种反应体系的酶或蛋白等。
蛋白质分选
(proteinsorting)
主要是指膜结合核糖体上合成的蛋白质,通过信号肽,在翻译的同时进入内质网,然后经过各种加工和修饰,使不同去向的蛋白质带上不同的标记,最后经过高尔基体反面网络进行分选,包装到不同类型的小泡,并运送到目的地,包括内质网、高尔基体、溶酶体、细胞质膜、细胞外和核膜等。
广义的蛋白质分选也包括在游离核糖体上合成的蛋白质的定位。
共翻译转运
(co-translationaltranslocation)
膜结合核糖体上合成的蛋白质,在它们进行翻译的同时就开始了转运,主要是通过定位信号,一边翻译,一边进入内质网,然后再进行进一步的加工和转移。由于这种转运定位是在蛋白质翻译的同时进行的,故称为共翻译转运。在膜结合核糖体上合成的蛋白质通过信号肽,经过连续的膜系统转运分选才能到达最终的目的地,这一过程又称为蛋白质分选,或蛋白质运输(proteintrafficking)。
游离核糖体
(freeribosomes)
在蛋白质合成的全过程中,结合有mRNA的核糖体都是游离存在的(实际上是与细胞骨架结合在一起的),不与内质网结合。这种核糖体之所以不与内质网结合,是因为被合成的蛋白质中没有特定的信号,与核糖体无关。
膜结合核糖体
(membrane-boundribosomes)
结合有mRNA并进行蛋白质合成的核糖体在合成蛋白质的初始阶段处于游离状态,但是随着肽链的合成,核糖体被引导到内质网上与内质网结合在一起,这种核糖体称为膜结合核糖体。
这种核糖体与内质网的结合是由合成的新生肽N端的信号序列决定的,而与核糖体自身无关。
导肽
(leadingpeptide)
又称转运肽(transitpeptide)或导向序列(targetingsequence),它是游离核糖体上合成的蛋白质的N-端信号。
导肽是新生蛋白N-端一段大约20~80个氨基酸的肽链,通常带正电荷的碱性氨基酸(特别是精氨酸和赖氨酸)含量较为丰富,如果它们被不带电荷的氨基酸取代就不起引导作用,说明这些氨基酸对于蛋白质的定位具有重要作用。这些氨基酸分散于不带电荷的氨基酸序列之间。转运肽序列中不含有或基本不含有带负电荷的酸性氨基酸,并且有形成两性α螺旋的倾向。转运肽的这种特征性的结构有利于穿过线粒体的双层膜。不同的转运肽之间没有同源性,说明导肽的序列与识别的特异性有关,而与二级或高级结构无太大关系。
导肽运送蛋白质时具有以下特点:①需要受体;②消耗ATP;③需要分子伴侣;④要电化学梯度驱动;⑤要信号肽酶切除信号肽;⑥通过接触点进入;⑦非折叠形式运输。
氧化
(oxidation)
葡萄糖(或糖原)在正常有氧的条件下,经氧化产生CO2和水,这个总过程称作糖的有氧氧化,又称细胞氧化或生物氧化。整个过程分为三个阶段:①糖氧化成丙酮酸。葡萄糖进入细胞后经过一系列酶的催化反应,最后生成丙酮酸的过程,此过程在细胞质中进行,并且是不耗能的过程;②丙酮酸进入线粒体,在基质中脱羧生成乙酰CoA;③乙酰CoA进入三羧酸循环,彻底氧化。
糖酵解
(glycolysis)
葡萄糖在无氧条件下,生成丙酮酸的过程。此过程在细胞质中进行,并且是不耗氧的过程。
三羧酸循环(citricacidcycle)
由乙酰CoA和草酰乙酸缩合成有三个羧基的柠檬酸,柠檬酸经一系列反应,一再氧化脱羧,经α酮戊二酸、琥珀酸,再降解成草酰乙酸。而参与这一循环的丙酮酸的三个碳原子,每循环一次,仅用去一分子乙酰基中的二碳单位,最后生成两分子的CO2,并释放出大量的能量。
电子载体(electroncarriers)
在电子传递过程中与释放的电子结合并将电子传递下去的物质称为电子载体。参与传递的电子载体有四种∶黄素蛋白、细胞色素、铁硫蛋白和辅酶Q,在这四类电子载体中,除了辅酶Q以外,接受和提供电子的氧化还原中心都是与蛋白相连的辅基。
黄素蛋白(flavoproteins)
黄素蛋白是由一条多肽结合1个辅基组成的酶类,结合的辅基可以是FAD或FMN,它们是维生素B2的衍生物,每个辅基能够接受和提供两个质子和电子。线粒体中的黄素蛋白主要是电子传递链中NADH脱氢酶和TCA循环中的琥珀酸脱氢酶。
细胞色素(cytochromes)
细胞色素是含有血红素辅基的一类蛋白质。血红素基团是由卟啉环结合一个铁原子(铁原子位于环的中央)构成的。与NAD+和FAD不同,在氧化还原过程中,血红素基团的铁原子可以传递单个的电子而不必成对传递。血红素中的铁通过Fe3+和Fe2+两种状态的变化传递电子。在还原反应时,铁原子由Fe3+状态转变成Fe2+状态;在氧化反应中,铁由Fe2+转变成Fe3+。电子传递链中至少有五种类型的细胞色素∶a、a3、b、c和c1,它们间的差异在于血红素基团中取代基和蛋白质氨基酸序列的不同。
铁硫蛋白(iron-sulfurproteins,Fe/Sprotein)
铁硫蛋白是含铁的蛋白质,也是细胞色素类蛋白。在铁硫蛋白分子的中央结合的不是血红素而是铁和硫,称为铁-硫中心(iron-sulfurcenters)。最常见的是在蛋白质的中央含有四个原子,其中两个是铁,另两个是硫,称为[2Fe-2S],或在蛋白质的中央含有八个原子,其中四个是铁,另四个是硫,称为[4Fe-4S],并且通过硫与蛋白质的半胱氨酸残基相连。在铁硫蛋白中尽管有多个铁原子的存在,但整个复合物一次只能接受一个电子以及传递一个电子,并且也是靠Fe3+Fe2+状态的循环变化传递电子。
醌(uniquinoneUQ)或辅酶Q(coenzymeQ)
辅酶Q是一种脂溶性的分子,含有长长的疏水链,由五碳类戊二醇构成。如同黄素蛋白,每一个醌能够接受和提供两个电子和质子,部分还原的称为半醌,完全还原的称为全醌(UQH2)。
氧还电位(oxidation-reductionpotentials,redoxpotentials)
由于不同的还原剂具有不同的电子传递电位,而氧化与还原又是偶联的,如NAD+和NADH.它们的差别主要是电子数量不同,所以二者间就有一个电位差,即氧还电位。构成氧化还原的成对离子或分子,称为氧化还原对,或氧还对(redoxpair)。氧还电位在标准条件下测定,即得标准氧化还原电位(standardoxidationreductionpotentials,E0')。标准氧化还原电位的值越小,提供电子的能力越强。所谓标准条件是指1M反应浓度、25℃、pH7.0和1个大气压,测得的氧还电位用伏特(V)表示。
呼吸链(respiratorychain)
又称电子传递链,是线粒体内膜上一组酶的复合体。其功能是进行电子传递,H+的传递及氧的利用,最后产生H2O和ATP。
复合物I(complexI)
复合物I又称NADH脱氢酶(NADHdehydrogenase)或NADH-CoQ还原酶复合物,功能是催化一对电子从NADH传递给CoQ,它是线粒体内膜中最大的蛋白复合物,是跨膜蛋白,也是呼吸链中了解最少的复合物。哺乳动物的复合物Ⅰ含有42种不同的亚基,总相对分子质量差不多有1000kDa。其中有7个亚基都是疏水的跨膜蛋白,由线粒体基因编码。复合物Ⅰ含有黄素蛋白(FMN)和至少6个铁硫中心(iron-sulfurcenters)。一对电子从复合物Ⅰ传递时伴随着4个质子被传递到膜间隙。
复合物Ⅱ(complexⅡ)
复合物Ⅱ又称为琥珀酸脱氢酶(succinatedehydrogenase)或琥珀酸-CoQ酶复合物,功能是催化电子从琥珀酸传递给辅酶Q,由几个不同的多肽组成,其中有两个多肽组成琥珀酸脱氢酶,并且是膜结合蛋白。复合物Ⅱ参与的是低能电子传递途径,将琥珀酸的电子经FAD传给CoQ。复合物Ⅱ传递电子时不伴随氢的传递。
复合物Ⅲ(complexⅢ)
复合物Ⅲ又称CoQH2-细胞色素c还原酶复合物,总相对分子质量为250kDa。含1个细胞色素c1、1个细胞色素b(有两个血红素基团)、1个铁硫蛋白,其中细胞色素b由线粒体基因编码。复合物Ⅲ催化电子从辅酶Q向细胞色素c传递,并且每传递一对电子,同时传递4个H+到膜间隙。
复合物Ⅳ(complexⅣ)
复合物Ⅳ又称细胞色素c氧化酶(cytochromecoxidase)。总相对分子质量为200kDa。复合物Ⅳ是以二聚体的形式存在,它的亚基Ⅰ和Ⅱ都含有4个氧化还原中心(redox-activecenters)和两个a型细胞色素(含有1个a、1个a3)和两个Cu。主要功能是将电子从细胞色素c传递给O2分子,生成H2O∶4cytc2++O2+4H+→4cytc3++2H2O。每传递一对电子,要从线粒体基质中摄取4个质子,其中两个质子用于水的形成,另两个质子被跨膜转运到膜间隙。
电化学梯度(electrochemicalgradient)
质子跨过内膜向膜间隙的转运也是一个生电作用(electrogenesis),即电压生成的过程。因为质子跨膜转运使得膜间隙积累了大量的质子,建立了质子梯度。由于膜间隙质子梯度的建立,使内膜两侧发生两个显著的变化∶线粒体膜间隙产生大量的正电荷,而线粒体基质产生大量的负电荷,使内膜两侧形成电位差;第二是两侧氢离子浓度的不同因而产生pH梯度(ΔpH),这两种梯度合称为电化学梯度(electrochemicalgradient)。线粒体内膜两侧电化学梯度的建立,能够形成质子运动力(proton-motiveforce,Δp),只要有合适的条件即可转变成化学能储存起来。
ATP合酶(ATPsynthase)
ATP或称F0F1复合物(F0F1complexes),该酶在分离状态下具有ATP水解酶的活性,在结合状态下具有ATP合酶的活性,属F型ATPase。除了线粒体中有ATP合酶外,植物叶绿体的类囊体和好氧细菌都有ATP合酶的同源物,ATP合酶的分子组成和主要特点是:
头部:头部即F1,细菌和线粒体ATP合酶的F1都是水溶性的蛋白,结构相似,由5种多肽(α、β、γ、δ和ε)组成的九聚体(α3β3γδε),α亚基和β亚基构成一种球形的排列,头部含有三个催化ATP合成的位点,每个β亚基含有一个。
柄部∶由F1的γ亚基和ε亚基构成柄部,将头部与基部连接起来。γ亚基穿过头部作为头部旋转的轴。构成基部的亚基b向外延伸成为柄部的构成部分。
基部∶基部称为F0,是由镶嵌在线粒体内膜的疏水性蛋白质所组成,由3种不同的亚基组成的十五聚体(1a:2b:12c)。其中c亚基在膜中形成物质运动的环,b亚基穿过柄部将F1固定;a亚基是质子运输通道,允许质子跨膜运输。
氧化磷酸化(oxidativephosphorylation)
在活细胞中伴随着呼吸链的氧化过程所发生的能量转换和ATP的形成,称为氧化磷酸化。
化学渗透假说(chemiosmoticcouplinghypothesis)
英国生物化学家P.Mitchell于1961年提出的解释释氧化磷酸化偶联机理的假说。该学说认为:在电子传递过程中,伴随着质子从线粒体内膜的里层向外层转移,形成跨膜的氢离子梯度,这种势能驱动了氧化磷酸化反应(提供了动力),合成了ATP。这一学说具有大量的实验证明,得到公认并获得了1978年诺贝尔奖。化学渗透学说可以很好地说明线粒体内膜中电子传递、质子电化学梯度建立、ADP磷酸化的关系。
内共生学说(endosymbionthypothesis)
关于线粒体起源的一种学说。认为线粒体来源于细菌,即细菌被真核生物吞噬后,在长期的共生过程中,通过演变,形成了线粒体。该学说认为:线粒体祖先原线粒体(一种可进行三羧酸循环和电子传递的革兰氏阴性菌)被原始真核生物吞噬后与宿主间形成共生关系。在共生关系中,对共生体和宿主都有好处:原线粒体可从宿主处获得更多的营养,而宿主可借用原线粒体具有的氧化分解功能获得更多的能量。
非内共生学说
又称细胞内分化学说。认为线粒体的发生是质膜内陷的结果。有几种模型,其中Uzzell的模型认为:在进化的最初阶段,原核细胞基因组进行复制,并不伴有细胞分裂,而是在基因组附近的质膜内陷形成双层膜,将分离的基因组包围在这些双层膜的结构中,从而形成结构可能相似的原始的细胞核和线粒体、叶绿体等细胞器。后来在进化的过程中,增强分化,核膜失去了呼吸和光合作用,线粒体成了细胞的呼吸器官,这一学说解释了核膜的演化渐进的过程。
线粒体_线粒体 -起源
目前有两种不同的假说,即内共生假说和分化假说。
内共生假说
线粒体来源于被原始的前真核生物吞噬的好氧性细菌(该细菌有可能是革兰氏阴细菌);这种细菌和前真核生物共生,在长期的共生过程中演化成了线粒体。
证据:1它的基因组大小,形态,结构与细菌相似。都由裸露、环状双链DNA构成,不含组蛋白。
2有自己完整的蛋白质合成系统,能合成一部分自己需要的蛋白质。
3内外膜结构,成分差异大,外膜与细胞内膜相似,内膜与细菌质膜相似
4与细菌一样能用二分裂繁殖自我
不足之处:
从进化角度,如何解释在代谢上明显占优势的共生体反而
将大量的遗传信息转移到宿主细胞中?
◆不能解释细胞核是如何进化来的,即原核细胞如何演化为
真核细胞?
◆线粒体和叶绿体的基因组中存在内含子,而真细菌原
核生物基因组中不存在内含子,如果同意内共生起源
学说的观点,那么线粒体和叶绿体基因组中的内含子
从何发生?
分化假说
线粒体在进化过程中的发生是由于质膜的内陷,再分化后形成的。
主要内容:真核细胞的前身是一个进化上比较高等的好氧细菌。
◆成功之处:解释了真核细胞核被膜的形成与演化的渐进过程。
◆不足之处:
◆实验证据不多
◆无法解释为何线粒体、叶绿体与细菌在DNA分
子结构和蛋白质合成性能上有那么多相似之处
◆对线粒体和叶绿体的DNA酶、RNA酶和核糖体
的来源也很难解释。
◆真核细胞的细胞核能否起源于细菌的核区?
线粒体_线粒体 -线粒体实验
染色观察
显微镜下
线粒体――示教:3号片
小狗胰脏,Regaud氏液固定,石蜡切片,铁苏木素染色。
线粒体用铁苏木素染色呈黑色,分布于核周围的细胞质中,线粒体在高倍镜下呈粒状、线状或短棒状,或直或曲,轮廓鲜明。
胰脏的分泌细胞呈锥形,核大而圆,位于细胞中央,细胞游离端聚集有许多大而圆的黑色颗粒为分泌颗粒。
提取观察
线粒体是细胞中重要的细胞器,存在于绝大多数生活细胞中,它的主要功能是提供细胞内各种物质代谢所需要的能量。正由于这样,对线粒体膜,呼吸链酶及线粒体DNA等成分的结构,功能以及物理化学性质的研究已经成为细胞生物学研究中的重要课题,所以提取线粒体的技术已经成为线粒体研究中必不可少的手段,线粒体大量存在于代谢旺盛的细胞中,如动物的心肌,肝,肾等器官和组织的细胞中,大量置备线粒体就是从这些器官组织中提取,当所用样品较少时(如电镜和光镜的观察)可采用从组织培养细胞中提取,本实验就是介绍两种材料制备用于光镜观察的线粒体。
一、目的与要求
了解提取线粒体的基本原理及其过程,通过光学显微镜的观察了解体外分离的线粒体的一般形态
二、基本原理
线粒体具有完整的结构,一定的大小和质量,低温条件下在等渗液中破碎细胞,差速离心后,获得线粒体。经活性染料健那绿JanusgreenB染色,线粒体呈浅蓝色。
三、实验内容
1.线粒体的分离提取2.鼠肝的匀浆制备3.线粒体的活体染色
四、实验步骤
(一)动物组织线粒体的分离,提取与观察
显微镜检查:将1%JanusgreenB溶液按1:1比例加入线粒体悬液中,在室温或水浴中染15~20分钟,用吸管吸取一滴线粒体悬液,滴于载玻片上,加盖玻片后,放显微镜下进行观察,线粒体为蓝绿色圆形颗粒。
2.组织培养细胞的线粒体的提取与观察
操作中应该注意的问题
1.整个操作过程为保证线粒体的完整,应尽量使操作时的环境如温度(0―4℃),pH(7.0左右)保持恒定,同时尽可能短操作时间。
2.组培细胞消化时要特别小心,防止损失或反复。(损失指细胞脱落到消化液中)。
3.匀浆时,所用的介质一定是等渗缓冲液,常用的有0.25mol/L蔗糖溶液或生理盐水代替Hank’s液
4.匀浆次数依照匀浆器的松紧而定,次数过少,细胞破损不完全,就会影响线粒体产量。
5.所以取2/3上清夜用来制备线粒体是为防止细胞碎片过多影响观察。
6.整个分离过程,一般最好在30―60分钟内完成,不宜过长。光合作用中放大太阳能那无声的轰鸣。
 爱华网
爱华网