铜锌原电池之一
[原理]
铜、锌两电极,一同浸入稀H2SO4时,由于锌比铜活泼,容易失去电子,锌被氧化成Zn2+进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子,被还原成氢原子,氢原子结合成氢分子从铜片上放出。两极发生如下反应:
负极:Zn-2e=Zn2+
正级: Cu2++2e=Cu(硫酸铜溶液为电解质溶液)
[用品]
试管,镊子,铜棒,HgCl2,0.1mol・L-1硫酸溶液
[操作]
取一试管并斜放入一大粒纯锌(如没有纯锌可将粗锌泡在饱和的氯化汞溶液中,用镊子夹出冲洗净),再倒入0.1mol・L-1硫酸溶液,观察表面逸出气泡情况。
在盛有纯锌和0.1mol・L-1硫酸溶液中,用一根纯铜棒插在纯锌的表面上,可以观察到在锌表面气泡很少,而在插进液面中铜棒四周气泡很多。(如图)
铜表面气泡来源不可能是铜与稀硫酸反应,而是锌丢失的电子同遇到溶液中的氢离子发生了反应:
可以推知锌流出电子,在流经铜导线时,将电子转移给铜四周的氢离子。
锌铜原电池之二
[原理]
同之一
[用品]
烧杯、锌板、铜板、电流计、导线、0.1mol・L-1硫酸溶液
[操作]
如图所示,用一个烧杯(4)、盛入0.1mol・L-1的H2SO4溶液后,用固定锌、铜两电极的插座,把锌和铜(2)(3)两个电极浸泡在0.1mol・L-1H2SO4(5)中,再用电流计(1)和导线把两级连接好。
实验观察到的现象是,除铜极有氢逸出外,在电流计中还可以看到指针发生偏转,表示有电流产生。
锌(负极)
铜(正极)
[备注]
1.如果接通后,导线串连的电流计指针不发生偏转,或是瞬息偏转,都是失败的现象。在溶液与电极接触处如铜极无气体产生时,这也是失败的现象。
2.纯锌片若不好找到,可将粗锌置饱和氯化汞溶液中浸泡,用镊子取出,再经冲洗后可以使用。防止用手接触溶液,实验后一定要用肥皂洗手。
锌铜原电池之三
[原理]
[用品]
烧杯,KCl盐桥,1mol・L-1ZnSO4溶液,1mol・L-1CuSO4溶液,锌极板,铜极板,电流计,导线
[操作]
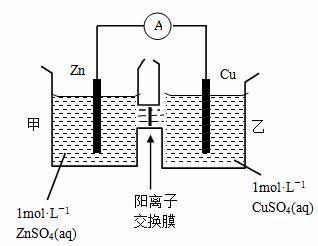
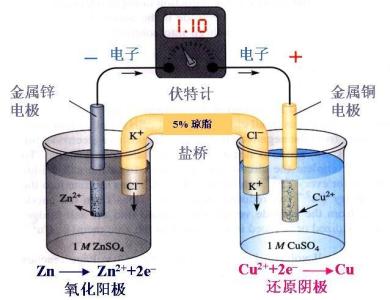
如图,在两烧杯中分别盛有(1)1mol・L-1ZnSO4溶液和(2)1mol・L-1CuSO4溶液,(3)为饱和氯化钾溶液的盐桥。操作和现象同之二所述。
[备注]
1.铜片面积大一些,便于学生观察。锌片纯一些,可以减少锌片上的气泡。
2.电流计可以用发光二极管或导电仪代替。用发光来检测电流通过,以提高学生的兴趣。
 爱华网
爱华网