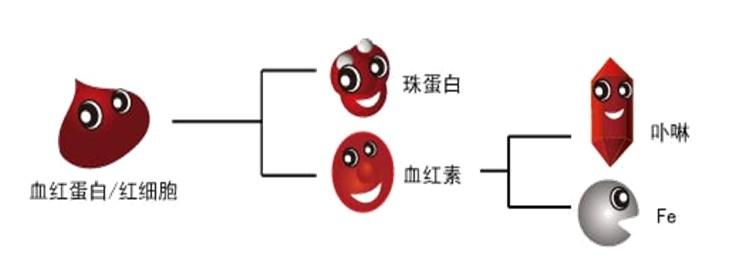
血红素,是(血红蛋白) 分子上的主要稳定结构,为血红蛋白、肌红蛋白等的辅基。分子式:C34H32N4FeO4。正常值:男性介于13.5-17.5,女性介于12-16 g/dl 。 如果超出正常范围;常见的原因包括:脱水、心肺疾病(如慢性阻塞性肺病、心衰竭)、 高山症、 红血球过多症(Polycythemia vera)等。 但必须参考其他血球检验项目及身体状况来找出可能原因。
血红素_血红素 -结构组成
人体内的每一个血红蛋白由四个珠蛋白和四个血红素(又称亚铁原卟啉)组成,每个血红素又由四个吡咯类亚基组成一个环,环中心为一个亚铁离子。每个血红蛋白则有四条多肽链,每条多肽链与一个血红素连接,构成血红蛋白的一个单体,或者说亚单位(即亚基)。在与人体环境相似的电解质溶液中血红蛋白的四个亚基可以自动组装成α2β2的形态。
血红素
组成珠蛋白的四条肽链各不相同,成年人可由2条α链和2条β链构成,称HbA。胎儿由2条α链2条γ链构成,称HbF。出生后不久由HbA取代。即血红蛋白由一个珠蛋白和四个血红素组成,而珠蛋白的一条肽链与一个血红素结合成为血红蛋白的一个亚单位,四个亚单位之间及亚单位内部以盐键相互结合。每个血红素基团中间的亚铁则可以与氧结合使之成为氧合血红蛋白。与氧结合或解离将影响盐键的形成或断裂,使Hb的四级结构发生改变,其与氧的亲和力亦随之改变,是氧解离曲线成S形和波尔效应的基础。
血红素_血红素 -物性数据
1.性状:是高等动物血液和肌肉中的红色色素。从乙酸或从氯仿-吡啶-冰乙酸中结晶呈长的薄体状晶,在透射光中呈棕色,反射光中呈钢蓝色。
2..溶解性:易溶于稀氨水
血红素_血红素 -提取测定
提取原理 血红蛋白在pH低于3.0时,血红素与珠蛋白的结合最为疏松,此时加入有机溶剂丙酮,使珠蛋白变性凝固,血红素则溶于丙酮中,在丙酮中加入适量的鞣酸或乙酸钠,可得到较纯的血红素结晶,然后用乙醇一乙醚洗涤,可得到精制血红素。血红素在波长385处有最大吸收,可直接进行比色测定。
试剂器材
1.试剂0.5%~1%柠檬酸三钠;生理盐水;95%乙醇;氯仿;0.15%亚硫酸氢钠;丙酮;0.1 mol/L NaOH;1 mol/L盐酸,血红素标准品。
2.器材离心机;真空浓缩装置;真空干燥机;分光光度计;新鲜猪血。
操作步骤
1.血红素制备与纯化
(1)新鲜猪血抗凝新鲜猪血,加入0.5%~1%柠檬酸三钠溶液(V/V=10:1),搅拌均匀,得新鲜抗凝猪血。 (2)分离红细胞取抗凝猪血10 mL于离心管中,以3 000 r/min离心15 min,倾出上清液(血浆),收集红细胞,用0.9%NaCl洗涤2次。洗涤方法为:用适量生理盐水悬浮红细胞,搅拌均匀,离心,收集红细胞沉淀,测定红细胞体积(mL)。
(3)溶血加入相当于红细胞体积1倍的去离子水、0.25倍95%乙醇,搅拌30 min,红细胞吸水胀裂,血红蛋白释放出来。
(4)分离血红蛋 白溶血后加人红细胞体积0.15倍的氯仿,搅拌15 min,离心,得到含血红蛋白的沉淀物。
(5)分离血红素 上述沉淀物中加入相等于红细胞体积的0.15%亚硫酸氢钠溶液,使其溶解,然后加入红细胞体积4倍的丙酮,搅拌均匀,用0.1 mol/L盐酸溶液调节pH为3,使珠蛋白与血红素充分分离(抽提时间为10 min以上),然后4000 r/min离心10 min,弃沉淀,上清液即为血红素丙酮溶液。
(6)血红素纯化 血红素丙酮溶液采用真空浓缩并回收丙酮,浓缩物用0.1 mol/L NaOH溶解,3 000 r/min离心10 min,收集上清液。用0.1 mol/L盐酸调pH至4~5,沉淀血红素,收集沉淀,用水洗沉淀至中性,50℃真空干燥至恒重,得血红素。测定血红素制品的重量(mg)。
2.血红素测定
以0.1 mol/L NaOH分别溶解血红素标准品和提取得到的血红素制品,调整至适宜浓度,于385 nm处测定吸光度,计算样品中血红素提取率及纯度。
血红素_血红素 -合成分解
生物合成
红细胞中最主要成分是血红蛋白,约占其湿重的32%、干重的97%。血红蛋白是由珠蛋白与血红素结合而成。血红素不仅是Hb的辅基,也是肌红蛋白、细胞色素、过氧化物酶等的辅基二血红素可在体内多种细胞内合成,参与血红蛋白组成的血红素主要在骨髓的幼红细胞和网织红细胞中合成。珠蛋白的生物合成与一般蛋白质相同,故下面介绍血红素的合成。体内合成血红素的基本原料是甘氨酸、琥珀酰辅酶A和Fe2+。
血红素的合成过程
图1:血红素的生物合成
(1)δ-氨基-γ-酮戊酸(ALA)的生成:在线粒体内,甘氨酸和琥珀酰CoA在ALA合成酶催化下,缩合生成ALA。此反应需要磷酸呲哆醛作为辅酶,ALA合成酶是血红素合成的限速酶。
(2)卟胆原的生成:ALA生成后扩散到胞浆,两分子AI。A在ALA脱水酶作用下,脱水缩合生成一分子卟胆原(PBG)。
(3)尿卟啉原Ⅲ及粪卟啉原Ⅲ的生成:在胞浆四分子卟胆原在卟胆原脱氨酶和尿卟啉原Ⅲ同合酶协同催化下,脱氨缩合成尿卟啉原Ⅲ,再经尿卟啉原脱羧酶作用生成粪卟啉原Ⅲ。
(4)血红素的生成:粪卟啉原Ⅲ经扩散重新进入线粒体。在粪卟啉原氧化脱羧酶催化下,生成原卟啉原Ⅸ,再经氧化酶作用,生成原卟啉Ⅸ。后者和Fe卜在血红素合成酶催化下,生成血红素。血红素由线粒体转入胞浆与珠蛋白结合成血红蛋白。(图1)
代谢分解
含血红素蛋白的代谢在哺乳动物中需要:
①对卟啉环剪切产生的疏水性产物进行处理;
②所含铁的保留和动用,使其重新被利用。红细胞的生存周期大约为120天,衰老细胞通过膜的改变被识别,并被血管外的网状内皮系统吞噬。珠蛋白链变性后,将血红素释放于细胞质中;珠蛋白被降解为其组成的氨基酸,重新被利用以满足一般代谢的需要。
图2:血红素到胆红素的形成
如图2描述了血红素代谢的过程。血红素主要通过网状内皮细胞中的内质网内的酶降解,这一过程需要氧分子和NADPH参与。血红素加氧酶(heme oxygenase)有两个异构体,I型是底物诱导型,Ⅱ型是组成型。该酶催化一个亚甲基桥的剪切,这个亚甲基桥连接包含乙烯基取代基的两个吡咯基团。
一个亚甲基碳转变为一氧化碳,这是人体内一氧化碳(carbon monoxide)唯一的内生性来源。一部分一氧化碳通过呼吸道释放,因此,通过测定呼出的一氧化碳可作为衡量个体血红素降解情况的指标。一氧化碳中的氧和新生衍生性内酰胺环中的氧均完全来源于氧分子。通过化学计量,每剪切一个环,反应需要3mol氧。血红素加氧酶只能以血红素作为底物,铁可能参与了剪切反应。因此,自由原卟啉Ⅸ不是其底物。线性四吡咯胆绿素Ⅸ(biliverdinⅨ)通过血红素加氧酶形成。胆绿素Ⅸ被胆绿素还原酶(biliverdin reductase)还原为胆红素Ⅸ。
血红素_血红素 -作用功能
与氧结合
血红素与氧结合的过程是一个非常神奇的过程。首先一个氧分子与血红素四个亚基中的一个结合,与氧结合之后的珠蛋白结构发生变化,造成整个血红素结构的变化,这种变化使得第二个氧分子相比于第一个氧分子更容易寻找血红素的另一个亚基结合,而它的结合会进一步促进第三个氧分子的结合,以此类推直到构成血红素的四个亚基分别与四个氧分子结合。而在组织内释放氧的过程也是这样,一个氧分子的离去会刺激另一个的离去,直到完全释放所有的氧分子,这种有趣的现象称为协同效应。
血红素分子结构由于协同效应,血红素与氧气的结合曲线呈S形,在特定范围内随着环境中氧含量的变化,血红素与氧分子的结合率有一个剧烈变化的过程,生物体内组织中的氧浓度和肺组织中的氧浓度恰好位于这一突变的两侧,因而在肺组织,血红素可以充分地与氧结合,在体内其他部分则可以充分地释放所携带的氧分子。可是当环境中的氧气含量很高或者很低的时候,血红素的氧结合曲线非常平缓,氧气浓度巨大的波动也很难使血红素与氧气的结合率发生显着变化,因此健康人即使呼吸纯氧,血液运载氧的能力也不会有显着的提高,从这个角度讲,对健康人而言吸氧的所产生心理暗示要远远大于其生理作用。当血液内红细胞破坏过多,肝脏负荷增加肝细胞内运送、结合和排泄障碍,或肝外胆道阻塞,都可引起血内胆红素浓度增高而出现黄疸。
其他功能
除了运载氧,血红素还可以与二氧化碳、一氧化碳、氰离子结合,结合的方式也与氧完全一样,所不同的只是结合的牢固程度,一氧化碳、氰离子一旦和血红素结合就很难离开,这就是煤气中毒和氰化物中毒的原理,遇到这种情况可以使用其他与这些物质结合能力更强的物质来解毒,比如一氧化碳中毒可以用静脉注射亚甲基蓝的方法来救治。
用作药物和保健品,有载氧、贮氧、促进氧化还原、进行电子传递等重要生物学功能。可用作半合成血卟啉(HP)及其衍生物(HPD)、原卟啉钠原料。也可用作肉类食品添加剂,主要作着色剂使用。
血红素_血红素 -作用介绍
除了运载氧,血红素还可以与二氧化碳、一氧化碳、氰离子结合,结合的方式也与氧完全一样,所不同的只是结合的牢固程度,一氧化碳、氰离子一旦和血红素结合就很难离开,这就是煤气中毒和氰化物中毒的原理,遇到这种情况可以使用其他与这些物质结合能力更强的物质来解毒,比如一氧化碳中毒可以用静脉注射亚甲基蓝的方法来救治。
在食品加工与储藏中的变化
血红素
在肉品的加工与储藏中,肌红蛋白会转化为多种衍生物,包括氧合肌红蛋白、高铁肌红蛋白、氧化氮肌红蛋白、氧化氮高铁肌红蛋白、肌色原、高铁肌色原、氧化氮肌色原、亚硝酰高铁肌红蛋白、亚硝酰高铁血红素、硫肌红蛋白和胆绿蛋白。这些衍生物的颜色各异,氧合肌红蛋白为鲜红,高铁肌红蛋白为褐色,氧化氮肌红蛋白和氧化氮肌色原为粉红色,氧化氮高铁肌红蛋白为深红,肌色原为暗红,高铁肌色原为褐色,亚硝酰高铁肌红蛋白为红褐色,最后三种物质为绿色。
新鲜肉放置空气中,表面会形成很薄一层氧合肌红蛋白的鲜红色泽。而在中间部分,由于肉中原有的还原性物质存在,肌红蛋白就会保持还原状态,故为深紫色。当鲜肉在空气中放置过久时,还原性物质被耗尽,高铁肌红蛋白的褐色就成为主要色泽。图9-5显示出这种变化受氧气分压的强烈影响,氧气分压高时有利于氧合肌红蛋白的生成,氧气分压低时有利于高铁肌红蛋白的生成。
鲜肉在热加工时,由于温度升高以及氧分压降低,肌红蛋白的球蛋白部分变性,铁被氧化成三价铁,产生高铁肌色原,熟肉的色泽呈褐色。当其内部有还原性物质存在时,铁可能被还原成亚铁,产生暗红色的肌色原。火腿、香肠等肉类腌制品的加工中经常使用硝酸盐或亚硝酸盐作为发色剂。血红素的中心铁离子可与氧化氮以配价键结合而转变为氧化氮肌红蛋白,加热则生成鲜红的氧化氮肌色原,用图9-6表示。因此,腌肉制品的颜色更加诱人,并对加热和氧化表现出更大的稳定性。但可见光可促使氧化氮肌红蛋白和氧化氮肌色原重新分解为肌红蛋白和肌色原,并被继续氧化为高铁肌红蛋白和高铁肌色原。这就是腌肉制品见光褐变的原因。
肉类偶尔变绿的原因
鲜肉不合理存放会导致微生物大量生长,产生过氧化氢、硫化氢等化合物。过氧化氢可强烈氧化血红素卟啉环的α
 爱华网
爱华网