讲讲自己在化学学科的经验吧。
====化学篇
所述内容包含以下:概念、电化学、四大平衡、实验
概念类化学中一般都会考到一些概念性的或者有迷惑性的句子正误判断。(比如图中的是2014年的考题)
关于这类题目,我没有什么好多说的具体内容,主要是平时这方面的积累。多看看课本中老师没有着重强调和你没有划过线的内容!你没有看到过但确确实实在课本上的内容一旦出现,是最能坑死人的。(因为课本上有些句子的叙述看起来非常不合理,但是就是TMD对的,你没看到过就很有可能把它判错。切身体会)
平衡个人认为平衡是高中化学中最合理和精彩的一块,自成体系,自圆其说。平衡移动原理、平衡常数、四大平衡等等,都让我更加深刻地理解了这个世界,我就讲讲这几个内容吧。
平衡移动原理个人认为它本质就是“削弱”。有什么变化都削弱这种变化,你压强增大我就让反应朝压强减小的方向进行;你温度升高,我就让反应朝降温的方向进行。
但是,注意!削弱并不等于完全抵消!
比如与的色彩变化(两者都是气态)。把所在容器压缩一倍(不液化),这个时候因为浓度变成了原来的两倍,它的红棕色变得更加深了,但是反应的平衡要朝着减小浓度的方向移动(也就是去生成),这个时候体系的红色又会变淡。问题是,现在的红色与开始的红色,哪一个色彩更加深一点?答案是现在的。因为,平衡移动只会削弱这种变化,而做不到完全抵消。如果用数字表示色彩深浅,刚开始是5,压缩后是10,达到平衡后的结果就是8。
平衡移动原理的其他应该都算容易理解,只是这个“削弱”问题,曾经困扰过我不少时间。希望我的图能帮助大家理解。
平衡常数关于反应方程式和平衡常数之间有个非常浅显但是又很特殊的联系。但我一直觉得很奇怪,因为不但老师没有讲过,而且我查遍了市面上的典型教材(五三啦、龙门啦、重难点啦),都没有提到这样一个关系。
下面,我就用醋酸的电离和水解的三个方程式来介绍一下这种联系。
①⇋
②⇋
③⇋
其中,方程式间的关系为,②式-①式=③式;而平衡常数K之间的关系为,.
即:两式相加,对应的K相乘;两式相减,对应的K相除。
看到这里,你们有没有想到什么类似的东西?
对,这其实是有点类似对数函数的性质。
这般理解之后,就能统一反应方程式和平衡常数之间的关系,甚至还有它的定义。
比如
mA+nB⇋pC+qD 它的(直接用字母表示浓度,下同)
换一个形式,也就是
怎么样,和方程式惊人的统一吧?
(话说谁上过大学化学,告诉一下这个平衡常数到底怎么定义出来的,真心超级佩服那个大神哇)
讲讲这个关系的应用
①互逆反应
⇋
⇋
即 与 互为倒数
②电离水解
①⇋
②⇋
③⇋
即一种酸的电离平衡常数与对应酸根离子水解平衡常数的乘积等于水的离子积常数。这个结论曾让我有种满满的优越感。(捂脸)因为连我们的老师都没有讲过,很多被我这么一指导的同学都有种醐醍灌顶的感觉。(捂脸)
四大平衡
四大平衡指(如果我没记错的话),普通平衡(好吧一巴掌拍死我吧,真忘记这叫啥了)、弱电解质电离平衡、盐类水解平衡和沉淀溶解平衡。
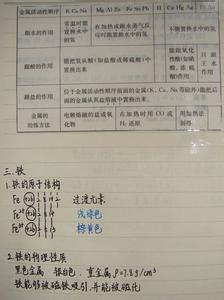
普通平衡没啥好讲的,倒是弱电解质的电离平衡和盐类的水解平衡大有文章可做。至于沉淀溶解平衡,内容相对不多,我也就少讲几句。
由可得诸多结论。(为弱电解质电离平衡常数,为该电解质对应弱电解质离子的水解平衡常数)
①
根据和的大小,能比较酸(碱)的强弱,盐的酸碱性。
比如
的
的,
的
几种酸的酸性强弱就是:>>>
再比如
的
的
这两个值大小相近,所以就呈中性。
②
ⅰ. 弱电解质的酸(碱)性越强,对应的弱电解质离子的水解能力越弱。
ⅱ.弱电解质的酸(碱)性越弱,对应的弱电解质离子的水解能力越强。
这个非常好理解,酸(碱)性越强,对应的电离平衡常数就越大,而是个不变的值,那么就必然越小。
比如
的
的,
的
几种酸的酸性很好判断,>>>
那么,对应的酸根离子的水解能力,就是>>>
③由此扩展到一个更强的结论
ⅰ. 若,则弱电解质的电离能力大于对应弱电解质离子的水解能力
ⅱ.若,则弱电解质的电离能力小于对应弱电解质离子的水解能力
换一种表示形式就是
ⅰ. 若,则弱电解质的电离能力大于对应弱电解质离子的水解能力
ⅱ.若,则弱电解质的电离能力小于对应弱电解质离子的水解能力
这个结论有什么应用?能判断等物质量浓度的弱电解质和弱电解质离子共存体系的酸碱性
比如
的
因为
所以的电离大于水解
所以,含等物质量和的溶液呈酸性
同理,可判断含等物质量和的溶液呈碱性
④判断一种酸和另一种酸的酸根离子共存体系中酸的电离程度和酸根离子水解程度(这个太偏了,暂时不写)
电化学评论中知友和我想的看法基本一致:电化学的本质是电子的流动。所有关于电化学出来的题目,都是围绕着电子转。
①电极命名
对于电极名称这一块,有没有觉得很奇怪很搞脑子,为何原电池中的负极在内电路中是阳极,而电解池中的负极却对应阴极?
其实,电极的命名本质上是统一的,就是根据电子的流向来命名。
负极和正极:这是外部表现的命名,负极就是电子流出,正极就是电子流入。和生活中我们所用的电池是正好匹配的。(这句话是不是废话…)
阴极和阳极:这是内部表现的命名,阳极是电子流失,阴极是电子流入。
而理解这个名称命名最关键的地方,就是把内部和外部分开来看。
对于原电池来说
从内部看,Zn极板失去电子,作为阳极,Cu极板得到电子,作为阴极。
而Zn极板失去的电子,不会从溶液中移动过去,所以会从外部导线中流出。
那么我们从外部看到的结果就是,Zn极板处有电子移动出来,那么它就是负极。Cu极板处有电子流进去,它就是正极。
而对于电解池来说
从外部看,负极自然是电子流出,正极自然是电子流入。
如图中所示,负极流出的电子,进入了内部之后,得到电子变成Cu。这一碳极是不是很自然的就应该是负极?
同理可以得到正极所连的碳极是作为阳极。
②内部反应中离子的流向
离子的流向,也一度让我费解。因为我那化学老师只是反复地强调,原电池和电解池内部离子流动方向不一样,原电池是阳离子去正极,电解池是阳离子去负极,从未讲过为什么,让我们记住就行了。(真是悲哀…)但是对于我这种从来不喜欢记忆的人,只好去想想有没有快捷方便的记法,结果让我发现了这个离子流向,在原电池和电解池中的本质也是一样的。
很简单,就是:阳离子往阴极跑,阴离子往阳极跑。
记住这个以后就把老师的绕口令丢掉吧。
根据①我们已经知道了原电池和电解池的内部名称不同,所以我们看到的现象就是原电池和电解池内部离子流动方向不一样。但是一旦你知道了上面那个结论,你就会发现,内部电子的移动其实非常合理,沟通内电路,平衡电荷量。
以上就是我在电化学上自己的体会。
(先写实验吧,推断有点忘了,让我想想)
化学实验
实验是我觉得高中化学里面最最麻烦的一块,我们的老师也曾说过,实验题无底,让我们老师去做也不一定能做全对。
但是熟悉一定套路以后,就会发现大部分的实验还是有迹可循的。
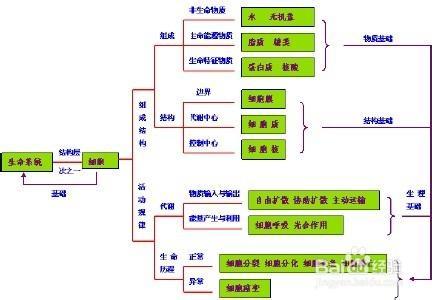
我根据自己的经验,总结出这么一张思维导图。
我以为,化学实验题考的就是考这么前中后三个实验步骤。
比如实验准备,
针对①装置组装,能出装置排序、新仪器的使用(如三颈烧瓶、滴液漏斗等等)这样的题;
针对②气密性检查,可以出检查气密性、判断装置安装是否有问题、仪器的使用原理等等;
……
再比如反应过程,
针对①加热,可以考查水浴、油浴、沙浴等等;
针对②搅拌,可以考查搅拌装置的选择(玻璃棒、金属棒、电磁搅拌器等等);
针对③反应物导出,可以考查冷凝回流的相关知识;
……
我是拿这张图和实验题的每一个小题一一比对,把实验题的每一个空抽象到对应的部分,然后通过不断的练习,然后形成自己的答题模式,最后能有较大的把握拿到绝大多数的分数。
以上便是我在实验方面的心得吧。
推断我思考了整整了大半个月,也想不出自己是如何做推断的,感觉就像是天时地利人和,一蒙就对,所以真写不出啥自己的感触来。对不住大家厚爱啦 :-(
于是乎化学篇到此为止吧。
完 1/4 1 2 3 4 下一页 尾页
 爱华网
爱华网