传播途径
HIV感染者是传染源,曾从血液、精液、阴道分泌液、乳汁等分离得HIV。握手,拥抱,接吻,游泳,蚊虫叮咬,共用餐具,咳嗽或打喷嚏,日常接触等不会传播。以下介绍主要三种传播方式:
性接触传播
HIV存在于感染者精液和阴道分泌物中,性行为很容易造成细微的皮肤粘膜破损,病毒即可通过破损处进入血液而感染。无论是同性还是异性之间的性接触都会导致艾滋病的传播。艾滋病感染者的精液或阴道分泌物中有大量的病毒,在性活动(包括阴道性交、肛交和口交)时,由于性交部位的摩擦,很容易造成生殖器黏膜的细微破损,这时,病毒就会趁虚而入,进入未感染者的血液中。值得一提的是,由于直肠的肠壁较阴道壁更容易破损,所以肛门性交的危险性比阴道性交的危险性更大。
血液传播
人体被输入含有HIV的血液或血液制品、静脉吸毒、移植感染者或病人的组织器官都有感染艾滋病的危险性。
母婴传播
感染了HIV的妇女在妊娠及分娩过程中,也可将病毒传给胎儿,感染的产妇还可通过母乳喂养将病毒传给吃奶的孩子。
致病机制
HIV选择性的侵犯带有CD4分子的,主要有T4淋巴细胞、单核巨噬细胞、树突状细胞等。细胞表面CD4分子是HIV受体,通过HIV囊膜蛋白gp120与细胞膜上CD4结合后,gp120构像改变使gp41暴露,同时gp120-CD4与靶细胞表面的趋化因子CXCR4或CXCR5结合形成CD4-gp120-CXCR4/CXCR5三分子复合物。gp41在其中起着桥的作用,利用自身的疏水作用介导病毒囊膜与细胞膜融合。最终造成细胞被破坏。其机制尚未完全清楚,可能通过以下方式起作用:
1.由于HIV包膜蛋白插入细胞或病毒出芽释放导致细胞膜通透性增加,产生渗透性溶解。
2.受染细胞内CD-gp120复合物与细胞器(如高尔基氏体等)的膜融合,使之溶解,导致感染细胞迅速死亡。
3.HIV感染时未整合的DNA积累,或对细胞蛋白的抑制,导致HIV杀伤细胞作用。
4.HIV感染细胞表达的gp120能与未感染细胞膜上的CD4结合,在gp41作用下融合形成多核巨细胞而溶解死亡。
5.HIV感染细胞膜病毒抗原与特异性抗体结合,通过激活补体或介导ADCC效应将细胞裂解。
6.HIV诱导自身免疫,如gp41与T4细胞膜上MHCⅡ类分子有一同源区,由抗gp41抗体可与这类淋巴细胞起交叉反应,导致细胞破坏。
7.细胞程序化死亡(programmed cell death ):在艾滋病发病时可激活细胞凋亡 (Apoptosis) 。如HIV的gp120与CD4受体结合;直接激活受感染的细胞凋亡。甚至感染HIV的T细胞表达的囊膜抗原也可启动正常T细胞,通过细胞表面CD4分子交联间接地引起凋亡CD+4细胞的大量破坏,结果造成以T4细胞缺损为中心的严重免疫缺陷,患者主要表现:外周淋巴细胞减少,T4/T8比例配置,对植物血凝素和某些抗原的反应消失,迟发型变态反应下降,NK细胞、巨噬细胞活性减弱,IL2、γ干扰素等细胞因子合成减少。病程早期由于B细胞处于多克隆活化状态,患者血清中lg水平往往增高,随着疾病的进展,B细胞对各种抗原产生抗体的功能也直接和间接地受到影响。
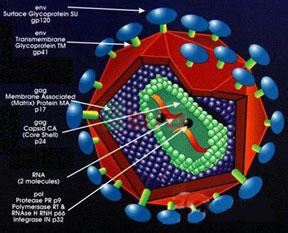
艾滋病人由于免疫功能严重缺损,常合并严重的机会感染,常见的有细菌(鸟胞内分枝杆菌复合体,MAI)、原虫(卡氏肺囊虫、弓形体)、真菌(白色念珠菌、新型隐球菌)、病毒(巨细胞病毒、单纯疱疹病毒,乙型肝炎病毒),最后导致无法控制而死亡,另一些病例可发生Kaposis肉瘤或恶性淋巴瘤。此外,感染单核巨噬细胞中HIV呈低度增殖,不引起病变,但损害其免疫功能,可将病毒传播全身,引起间质肺炎和亚急性脑炎。
艾滋病病毒进入人体后,首先遭到巨噬细胞的吞噬,但艾滋病病毒很快改变了巨噬细胞内某些部位的酸性环境,创造了适合其生存的条件,并随即进入T-CD4淋巴细胞大量繁殖,最终使后一种免疫细胞遭到完全破坏。
HIV感染后可刺激机体生产囊膜蛋白(Gp120,Gp41)抗体和核心蛋白(P24)抗体。在HIV携带者、艾滋病病人血清中测出低水平的抗病毒中和抗体,其中艾滋病病人水平最低,HIV携带者最高,说明该抗体在体内有保护作用。但抗体不能与单核巨噬细胞内存留的病毒接触,且HIV囊膜蛋白易发生抗原性变异,原有抗体失去作用,使中和抗体不能发挥应有的作用。在潜伏感染阶段,HIV前病毒整合入宿主细胞基因组中,因此HIV不会被免疫系统所识别,所以单单依靠自身免疫功能无法将其清除。
HIV病毒对人体的损害:HIV不仅使人体的免疫系统难以抵御其侵害,而且给特效治疗药物和预防用疫苗的研制带来困难。HIV直接侵犯人体的免疫系统,破坏人体的细胞免疫和体液免疫。它主要存在于感染者和病人的体液(如血液、精液、阴道分泌物、乳汁等)及多种器官中,它可通过含HIV的体液交换或器官移植而传播。
侵蚀细胞
现已证实HIV是嗜T4淋巴细胞和嗜神经细胞的病毒。HIV由皮肤破口或粘膜进入人体血液,主要攻击和破坏的靶细胞T4淋巴细胞(T4淋巴细胞在细胞免疫系统中起着中心调节作用,它能促进B细胞产生抗体),便得T4细胞失去原有的正常免疫功能。当激活免疫反应的T4细胞几乎全部被HIV消除,T4细胞抑制细胞在数量上巨增,相反病人体内T4细胞在数量上骤减,从而导致病人的免疫功能全部衰竭,为条件性感染创造了极为有利的条件。
HIV对神经细胞有亲合力,能侵犯神经系统,引起脑组织的破坏,或者继发条件性感染而致各种中枢神经系统的病变。
无视抗体
艾滋病病毒进入人体后,首先遭到巨噬细胞的吞噬,但艾滋病病毒很快改变了巨噬细胞内某些部位的酸性环境,创造了适合其生存的条件,并随即进入T-CD4淋巴细胞大量繁殖,最终使后一种免疫细胞遭到完全破坏。 HIV囊膜蛋白易发生抗原性变异,原有抗体失去作用,使中和抗体不能发挥应有的作用。在潜伏感染阶段,HIV前病毒整合入宿主细胞基因组中,免疫会把HIV忽略不被免疫系统识别,自身免疫无法清除。
人体免疫系统具有压制早期艾滋病病毒的能力。最近的研究表明,大多数新感染患者都会发展出中和抗体。这些抗体是附着在病毒之上的水滴状血液蛋白,如果它们仅面对一个目标,它们就能允许患者作出自我防御。但问题是,艾滋病病毒具有变异的能力,其掩饰自身的本领足以使其逃避抗体的压力,艾滋病病毒最终会瓦解免疫系统,使其耗竭。一些艾滋病病毒会使部分外层蛋白发生变异,变异后一种酶就有可能将一个糖分子附着其上,干扰抗体的攻击。但这种“聚糖盾牌”现象并不能在所有病例中观察到。其他病毒则会使中和抗体直接粘连的部分外层蛋白发生变异。[4]
HIV-1会入侵名为T淋巴细胞的免疫系统细胞,“劫持”T淋巴细胞的“分子机器”从而制造更多HIV-1,最终摧毁宿主细胞——这导致被感染的人群更易受到其它致命疾病的影响。然而,T淋巴细胞也不是易被击中的目标。在它们的反病毒防御系统里有一类名为APOBEC3s的蛋白质,后者具备阻止HIV-1自我复制的能力。然而,HIV-1也具备反防御机制——一种名为病毒体感染因子(Vif)的蛋白质,它能够导致T淋巴细胞摧毁自己的APOBEC3s。[5]
助发癌变
HIV和其它逆转录病毒一样,当逆转录酶使病毒的RNA作为模板合成DNA而成前病毒DNA整合到宿主细胞的DNA中时,HIV带有的致癌基因可使细胞发生癌性转化,特别是在细胞免疫遭到破坏,丧失免疫监视作用的情况下,细胞癌变更易发生。
夺取生命
艾滋病患者的存活时间长短与其被感染的亚型病毒种类有很大的关系。艾滋病患者的平均存活时间因被感染的亚型种类不同而有很大的差异,尽管这些研究对象被感染的病毒数量基本上是一样的。A亚型病毒感染者的平均存活时间为8.8年,而D亚型病毒感染者的平均存活时间降至为6.9年,而D亚型和A亚型病毒的混合感染者的存活时间更短,平均只有5.8年。
 爱华网
爱华网