(续接上帖)
谈热温商——熵(S)。
首先,在热力学上,熵这个概念的提出形式本身就严重违背了基本的变量逻辑。
众所周知,热力学又把熵称为“热温商”。但你翻遍所有的热力学教材后会发现,所谓“熵是‘热温商’”的说法从来都没有以数学形式体现过,即并没有S≡Q/T的表述。所有关于“熵”的定义,都是从“熵增”⊿S=Q/T(或者dS=dQ/T)开始,再反过来让读者自己去感悟熵S的概念,形成先定义“儿子”然后再回头定义“父亲”的滑稽局面。这种定义方式让人生疑:究竟是“熵S”叫做热温商,还是“熵变⊿S”叫做热温商?
为何热力学不直接给出熵的定义式?显然,热力学遇到了前所未有的变量逻辑困难,为了绕过这个困难,只好用迂回战术了。热力学认为熵是有绝对值的,但是一直都在计算熵变而从来都不是先计算过程始末两点的熵值再根据熵变的定义式⊿S≡S2-S1求得熵变。
在虚构了一个性质不明的“热温商”之后,热力学家彻底“忘记”了他们当初(通常在热力学教科书中,焓的概念在第一定律中出现而熵的概念是第二定律的内容)是如何把焓判定为一个状态函数的。众所周知,温度是一个状态函数(点存量、时点数),而“热”被机械地认定是一个过程函数,那么作为“热温商”的熵便是一个流量和一个存量的比值,既是状态函数(T)的函数,又是过程函数(Q)的函数,实在是无法逻辑地说明它到底是状态函数还是过程函数,变成了不伦不类、不知所云的东西。
热力学解决这个逻辑缺陷的方法是把事件过程归结为两个等温过程,先抽去温度的存量特性,使之“变成”一个随过程序号而改变的过程量,用过程量Q和一个过程量T相比得到热温商。但是逻辑上,两个过程函数相比的结果也应该是过程函数而不应该是状态函数!
这样偷换温度概念之后,那么作为过程量的Q和被偷换为过程量的T的比值就当然也是过程量,即熵变⊿S是过程量,这里已经背弃了“熵是热温商”的概念了。这倒是从反面佐证了前述“变量的变化(量变)是过程量”的论述。但是,从来没有见到一个物理学家和一部教科书有胆识明确指出,在⊿S=Q/T当中的T其实已经不是态函数,或者明确地说“熵变(⊿S)是过程函数”,他们对此中的逻辑不一致都采取了含而混之的回避态度。
这个由等温冷却循环过程导出热温商的做法,似乎和经济学把不同的购买过程看作是在“一定的价格水平”下进行的过程如出一辙。价格本来是状态函数(时点数、存量),对应于一种交换状态,是对交换事件的状态的描述,但是“一定的价格水平”的说法就彻底掩盖了价格的存量特性,变成了经济学上的一个“恒温过程”,而现实当中没有这种恒价的市场存在,因此,需求量和价格的关系就只能靠虚构的需求表数据支撑了。

为了确定熵是一个态函数,热力学家回避了用于确定焓的性质的变量逻辑,转而依据环积分∮的概念来说明,即经过一个循环而保持增量为0的变量就是状态函数。的确,环积分为零∮=0是完全符合状态函数特点的一项准则,但是,积分因子的构建本身就大有问题,因为如果不否定T是态函数,则一个过程函数是不可以对一个状态函数求微分的,这种做法缺乏科学的严肃性和逻辑严密,完全不足采信。
其次,从方法思路上看,“热”是描述两个不等温系统之间的热能传递过程的概念,所有的热力学教材都会提醒读者:热不是系统的性质,而只是系统状态变化时与环境交换的能量。因此,不能够说某物质内含有多少热。如前所述,宇宙没有外部,故而热力学的理论都是“内部理论”,因此时刻要记住,千万不要把从热力学得到的任何内部理论推延到“外部”。根据热力学理论来认识宇宙的做法就是犯了这种错误。热力学所使用的平衡态理念对于一个真正孤立系统来说,就意味着不存在“热”和“功”的概念。因此,基于“热传递”思路的熵概念,从一开始就是对孤立系统不可成立的,它永远无法回答“没有热过程的孤立平衡态物系怎么还会有热温商(熵)”这个问题。
在经济学上,这就像对于一个单独的私有者(如荒岛上的鲁滨逊)来说不存在“交易”问题一样,所以,《西方经济学的终结》反复向读者强调,交换是发生在两个私有者之间的现象、单一商品无所谓交换,也就无所谓作为交换比例的价格。
如前所说,描述存在状态的变量一定是存量而不是流量。说白一点,状态量就是状态量而非过程量。这是由状态函数和过程函数的定义所决定的。两种变量各有其功能和适用范围,既不能用静止于时点的状态量去描述过程,也不能用基于时间流动的过程量表述静态的状态。鉴于此,因为交换是一个时点上(私有权互易的时点)成立的事件,所以描述交换事件的变量统统都是状态函数,所以说,对于单独某次交换来说,购买量不是流量,不可等同于对应于一个时段的需求量。如果要设立一个状态函数描述孤立系统在某一时点上的状态,就不可能采用一个过程变量对之进行定义。热温商的熵概念永远无法回答“传热是一个过程,熵作为状态函数,表达的究竟是这个过程中哪一个时点上的物系状态?”这一问题。所以,“热温商”的说法或以热定义熵的做法就是一个严重的错误,完全违背了基本的变量逻辑。
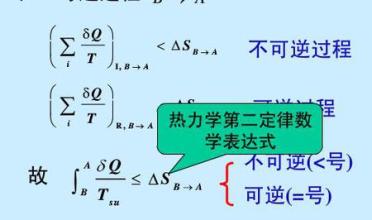
为探究热力学第二定律问题所在,我们来看基于克劳休斯不等式(Clausius inequality)的第二定律描述: dS≥δQ/T
热力学家将此式的物理意义描述为:若过程的热温商与熵差相等,则为可逆过程;若热温商小于熵变,则为不可逆过程。(参阅“熵和经济学”一帖第一部分当中的引用http://www.pinggu.org/bbs/dispbbs.asp?boardID=56&ID=139014&page=2)
这段描述中,一个明显的错误在于,它把dS称为“熵差”,而却刻意拒绝把δQ对等地叫做“热差”。那么,δQ究竟应该是“热变”还是“热”本身?!也就是说,到底Q/T是叫做热温商,还是δQ/T是热温商?!如果拒绝把δQ叫做“热变”,那么,面对于同一个等式中的内容,为何却要把dS叫做“熵差”而不是“熵”?!反过来说,如果δQ应该是“热变”,则δQ/T就应该被称为“热变温度商”而不是“热温商”!要知道,一个变量的“变”和变量本身是完全不同的概念。
事实上,这种把“量变”和“变量”混为一谈的做法,早在熵概念引出的时候就存在了。通常的热力学教材是基于一个等温的冷冻循环过程的效率概念引入熵概念的:
【Q1/T1+Q2/T2=0
即 ∮δQ可/T=0
比值Q可/T称为热温商。上式表示可逆循环热温商的和等于零,故该变量必为一状态函数。这个状态函数就叫熵,用符号S表示。于是
Q可/T=⊿S
对于无限小温度变化,Q可则为δQ可,⊿S则为dS
故 dS=δQ可/T 或 δQ可=TdS 】
“熵变⊿S”和“熵S”是完全不同的两个概念,我们不禁要问:明明定义了符号S表示热温商,为何不直接写出S=Q/T?而要悄然无声地改为用熵变⊿S表示热温商Q可/T了?那么“热温商”到底叫做“熵变”还是叫做“熵”?这个“于是Q可逆/T=⊿S”又是从何说起?
再者如前所述,过程函数是不可以微分的,用δ偷换d而实际上又当作d来运算,明显是一个数学上的错误和认识逻辑错误。数学上,δ应该是⊿的意思,而不是d的意思,前者表示点的一个运动,后者表示点的一种运动趋势。
显然,热力学家陷入了认知两难的困境之中。在糊涂的流量概念之下,既要坚持“热”一定是过程函数,又要把它当作状态函数来运算,只好采用瞒天过海的方法以δ替换d了(注:现在许多论著不像经典的热力学教材,甚至直接写dQ而不写δQ了,但是,这并不说明作者已经弄清楚变量逻辑关系,而是恰恰相反地,热力学家们陷入了难以自圆其说的、更深的内部逻辑矛盾当中了)。
如果熵是状态函数,表述的就是物系在某一时点上的状态,则“熵变”就是一个过程函数,描述的是一个变化过程。不可混为一谈。
这在经济学当中表现为,数理经济学家们既要坚守需求量的流量定义,又把杜撰出它同状态函数(价格P)的关系,完全没有认识到过程函数不可以对状态函数微分求导。(请续看下帖)
 爱华网
爱华网