化学反应速率与化学平衡图像是化学反应速率变化规律的示意图,常将图建立于平面直角坐标系中。化学反应速率的变化,化学平衡的变化(移动),都与反应物的温度、浓度、气体反应物的压强等因素有关。化学平衡的移动又与反应速率的变化之间有着密不可分的关系。所有这些都可以用一定形式的图像来表达,化学反应速率与化学平衡的图像都是以此为依据来设计的。
因此解决化学反应速率与平衡图像问题的基本方法可以从以下方面进行综合分析:一是借助于化学方程式掌握化学反应的特征;二是掌握该化学反应的速率变化与平衡移动的规律;三是掌握图中符号的含义,图中符号项目主要包括纵坐标、横坐标和图像,对图像要弄清楚其起点、拐点、交点、终点和走向(即“四点一向”)的含义。
下面举例说明此类问题的解题方法思路:
例题1:图1为反应A(s)+D(g)
E(g);ΔH<0的逆反应速率随时间的变化情形,试根据此曲线判断下列说法不正确的是( )
A.t3时刻可能采取的措施是减少c(D)
B.t5时刻可能采取的措施是降温
C.t7时刻可能采取的措施是减小压强
D.t7~t6时间段平衡向逆反应方向移动
解题指导:本题在讨论时要注意三点,一是注意题给反应物A是固体,二是图像中给出的纵坐标是用v逆来表示的,三是在对化学反应速率的影响因素讨论时需把整张图补齐后再分析(v正在原平衡线上方)。在讨论外界条件对反应速率的影响时要注意,只有浓度的变化对反应速率的影响有选择性,即增大反应物浓度则增大正反应速率,增大生成物浓度则增大逆反应速率。而温度、压强(对气体参加的反应有影响)、催化剂的影响是广泛的,不论反应吸热、放热,温度升高都将增大反应速率(反应物能量升高、活化分子百分数增加);不论气体体积增大还是缩小,增大压强都将增大反应速率(反应物的浓度增大、单位体积内活化分子数增大);使用催化剂一般将增大反应速率。t5时刻采取的措施应是增大c(D),同时减小c(E),因此平衡向正反应方向移动。
答案:BD
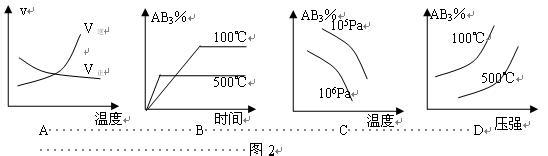
例题2:对于可逆反应2AB3(g)
A2(g)+3B2(g);ΔH>0,图2所示的图像中正确的是( )。
解题指导:A图为速率随温度的变化曲线,图中显示v(逆)线的斜率更大,即温度对逆反应速率影响更大,逆反应是吸热反应,所以正向是放热反应,这与题给信息不符;B图像中高温时AB3%低,所以温度升高时平衡正向移动,即正反应吸热;C图像中从一条曲线上分析知,随温度升高,AB3%降低,所以正向吸热,再作x轴的垂线可得,同温下随着压强的增大,AB3%降低,所以正向气体化学计量数减小,与题给信息不符;D中从一条曲线上分析知,随着压强增大,AB3%增大,所以正向气体化学计量数增大,而作x轴垂线可得,随着温度的升高,AB3%降低,所以正反应吸热。正确答案为BD。
规律总结:化学平衡图像图像的分析方法:(1)三步分析法:一看反应速率是增大还是减小;二看Δv正、Δv逆的相对大小;三看化学平衡移动的方向。(2)四要素分析法:看曲线的起点;看曲线的变化趋势;看曲线的拐点(转折点);看曲线的终点。(3)先拐后平:对于可逆反应
mA(g)+nB(g)
pC(g)+qD(g),在转化率-时间曲线中,先拐的曲线先达到平衡。在温度高、压强大的情况下,若转化率也较高,则反应中m+n>p+q;若转化率降低,则表示m+n 不论是化学反应速率图像还是化学平衡图像,都要搞清纵横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。
 爱华网
爱华网